
【题目】下列物质中,可以证明某化合物内一定存在离子键的是( )
A.可溶于水B.水溶液能导电
C.具有较高的熔点D.固体不导电,但熔融状态能导电
 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的净出率为70%时,所采用的实验条件为___________________。

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酯A,其分子式C6H12O2,已知

又知B、C、D、E均为有机物,D不与Na2CO3溶液反应,E不能发生银镜反应,则A结构可能有( )
A. 5种 B. 4种 C. 3种 D. 2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,在CH3COONa稀溶液中分别加入少量下列物质:
①固体NaOH;②固体KOH;③固体NaHSO4;④固体CH3COONa;⑤冰醋酸
其中一定可使c(CH3COO-)/c(Na+)比值增大的是 ( )
A. ①② B. ②⑤ C. ①⑤ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。这里用到的实验方法可用于分离
A. 苯和水 B. 食盐水和泥沙
C. 乙酸乙酯和乙酸 D. 硝酸钾和硫酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A. 质子数c>b B. 离子还原性Y2->Z-
C. 氢化物稳定性H2Y>HZ D. 原子半径X<W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氢键,下列说法正确的是( )
A.分子间形成的氢键使物质的熔点和沸点升高
B.冰中存在氢键,水中不存在氢键
C.每一个水分子内含有两个氢键
D.H2O是一种非常稳定的化合物,这是由于氢键所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 ![]() 溶液中逐滴加入稀硫酸。请完成下列问题:
溶液中逐滴加入稀硫酸。请完成下列问题:
(1)写出反应的离子方程式:__________________________。
(2)下列三种情况下,离子方程式与(1)相同的是__________(填序号)。
A. 向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液至溶液显中性
溶液至溶液显中性
B. 向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液至
溶液至![]() 恰好完全沉淀
恰好完全沉淀
C. 向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 溶液至沉淀完全
溶液至沉淀完全
(3)若缓缓加入稀硫酸至过量,整个过程中混合溶液的导电能力可以近似地用图中的_____(填序号)曲线表示。
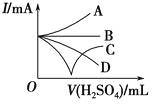
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年国产C919大型客机正式下线,标志着我国航空工业进入了新的发展阶段。先进材料首次在国产民用机大规模应用,第三代铝锂合金材料、先进复合材料在C919机体结构用量分别达到8.8%和12%。
(1)飞机的外壳采用第三代铝锂合金材料,我国已基本掌握了航空铝锂合金的熔炼技术。铝原子的外围电子排布式为_________________,电负性大小:锂_____(填“大于”或“小于”)铝,写出氢化锂与水反应的化学方程式 ________________。
(2)现代飞机为了减轻质量而不减轻外壳承压能力,通常采用复合材料,其成分之一为环氧树脂,常见的E51型环氧树脂中部分结构如下图所示:

其中碳原子的杂化方式为__________________。
(3)C919使用的钛材比例为9.3%。钛元素在周期表中位于_____区,钛的最高正化合价为______。
(4)C919制造过程中采用碳化钨做发动机的材料。右图为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙化合物。在此结构中,钨原子二维堆积方式为________,1个钨原子周围距离钨原子最近的碳原子有_____个 ,下列金属原子的堆积方式与碳化钨晶胞中碳原子和钨原子所处位置类似的是_________。

A. Cu Ag Au B. Zn Ti Mg C. Na K Fe D. Po
(5)假设该部分晶体的体积为Vcm3,密度为d g/cm3,阿伏加德罗常数为NA个/mol,则碳化钨的摩尔质量M用上述数据可以表示为_______。
(6)大型客机燃油用于四乙基铅做抗震添加剂。四乙基铅是无色油状液体,有臭味,常温下极易挥发。四乙基铅结晶时晶体类型是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com