
按照题目要求完成下列各小题(每空2分,共20分)
(1)写出下列反应的化学方程式:
①钠与水反应
②Al与氢氧化钠溶液的反应:
③过氧化钠粉末与水的反应:
④Fe与水在高温下反应:
⑤Fe(OH)2在潮湿的空气中转化为Fe(OH) 3:
(2)饱和氯化铁溶液常用于给伤口止血,实验室检验Fe3+的试剂为: ,向盛有氯化铁溶液的试管中滴加该试剂可观察到的实验现象为:
(3)KAl(SO4)2﹒12H2O俗称明矾,常用作净水剂,请用实验方法检验明矾溶液中所含有的主要离子,要求写出检验每种离子的基本操作方法、实验现象及结论。
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种短周期元素,核电荷数依次增加。只有E为金属,A与E同主族,B与F同主族,B原子最外层电子数是内层电子数的2倍,D最外层有两对成对电子。E+与C3-具有相同的电子层结构。请回答下列问题:
(1)F的价电子排布为______。
B、F形成的化合物晶体类型是_____。
(2)A、B、C、D形成的既有离子键又有共价键的化合物化学式为______。
(3)A、C形成的分子有_____对孤对电子、_____个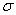 键,中心原子杂化方式为______。
键,中心原子杂化方式为______。
(4)稳定性:CA3_____FA4。离子半径:E+_______C3-。(填“>”或“<”
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是( )
A.H2O(g)===H2+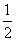 O2(g) ΔH=-485 kJ·mol-1
O2(g) ΔH=-485 kJ·mol-1
B.H2O(g)===H2(g)+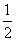 O2(g) ΔH=+485 kJ·mol-1
O2(g) ΔH=+485 kJ·mol-1
C.2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,有错误的是
A. Na2CO3比NaHCO3容易溶解于水
B. 将等物质的量的NaHCO3粉末与Na2CO3粉末同时分别倒入适量的相同浓度的稀盐酸中,前者的反应更剧烈
C. Na2CO3很稳定,而NaHCO3受热时容易分解
D. Na2CO3溶液能与石灰水反应,而NaHCO3溶液不能与石灰水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中的Cl-浓度与100 mL 1 mol ·L-1 MgCl2溶液中的Cl-浓度相等的是
A.200 mL 1 mol·L-1 KCl溶液 B.50 mL 2 mol·L-1 CaCl2溶液
C.150 mL 2 mol·L-1 NaCl溶液 D.50mL 1 mol ·L-1 AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.稀硫酸不具有氧化性 B.NH4Cl中只含有离子键
C.可用丁达尔效应区分溶液和胶体 D.金属阳离子被还原时一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中,始终无明显现象的是( )
A. NO2通入FeSO4溶液中 B. CO2通入CaCl2溶液中
C. NH3通入AlCl3溶液中 D. SO2通入已酸化的Ba( NO3 )2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种元素的原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原子价电子排布式为 。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为 (用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是
A.分子中都含有σ键和π键
B.中心原子都sp杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有
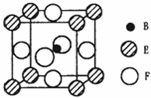 (5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 .若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为 。
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为 ,该晶体的化学式为 .若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com