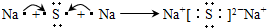有A、B、C、D四种无色气体,
①A能使湿润的红色石蕊试纸变蓝;
②一定条件下,A可以与B反应生成C,C遇空气变为红棕色;
③D与A混合生成白烟;
④D的浓溶液与软锰矿(主要成分是MnO2)在加热条件下反应可制取黄绿色气体E;按要求回答下列问题:
(1)写出②化学方程式 ;
(2)写出④的离子方程式 ;
(3)气体E有毒,实验室一般用 吸收,该反应的离子方程式是 .
【答案】
分析:有A、B、C、D四种无色气体,
①A能使湿润的红色石蕊试纸变蓝;是氨气的特征性质,判断为NH
3;
②一定条件下,A可以与B反应生成C,C遇空气变为红棕色;红棕色气体为NO
2,判断C为NO,
④D的浓溶液与软锰矿(主要成分是MnO
2)在加热条件下反应可制取黄绿色气体E;推断D为浓盐酸,黄绿色气体E为Cl
2;
③D与A混合生成白烟;说明A为NH
3,B为O
2,;
综上所述判断出的物质为:A为NH
3;B为O
2;C为NO;D为HCl;E为Cl
2;
解答:解:①A能使湿润的红色石蕊试纸变蓝;是氨气的特征性质,判断为NH
3;
②一定条件下,A可以与B反应生成C,C遇空气变为红棕色;红棕色气体为NO
2,判断C为NO,
④D的浓溶液与软锰矿(主要成分是MnO
2)在加热条件下反应可制取黄绿色气体E;推断D为浓盐酸,黄绿色气体E为Cl
2;
③D与A混合生成白烟;说明A为NH
3,B为O
2,;
综上所述判断出的物质为:A为NH
3;B为O
2;C为NO;D为HCl;E为Cl
2;
(1)反应②是氨气的催化氧化生成一氧化氮和水,一氧化氮和空气中氧气反应生成红棕色气体二氧化氮,反应的化学方程式为:4NH
3+5O
2
4NO+6H
2O;2NO+O
2=2NO
2 故答案为:4NH
3+5O
2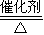
4NO+6H
2O;2NO+O
2=2NO
2;
(2)反应④是实验室制备氯气的反应生成氯化镁、氯气、水,反应的离子方程式为:MnO
2+4H
+
Mn
2++Cl
2↑+2H
2O;故答案为:MnO
2+2Cl
-+4H
+
Mn
2++Cl
2↑+2H
2O;
(3)气体E为氯气有毒不能排放到空气中污染环境,需要用氢氧化钠溶液吸收,反应的离子方程式为:Cl
2+2OH
-=Cl
-+ClO
-+H
2O;故答案为:NaOH溶液;Cl
2+2OH
-=Cl
-+ClO
-+H
2O;
点评:本题考查了氯气及其化合物性质的分析判断和反应现象的应用,化学方程式、离子方程式的书写是解题关键,题目较简单.

 4NO+6H2O;2NO+O2=2NO2
4NO+6H2O;2NO+O2=2NO2  4NO+6H2O;2NO+O2=2NO2;
4NO+6H2O;2NO+O2=2NO2; Mn2++Cl2↑+2H2O;故答案为:MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O;故答案为:MnO2+2Cl-+4H+ Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;