
【题目】某实验室模拟工业硫化碱法制取硫代硫酸钠(Na2S2O3)并探究其性质。
(1)制取硫代硫酸钠的反应装置及所需试剂如图:

①装置A中发生反应的化学方程式为__________________________。打开分液漏斗的活塞时,发现液体不能顺利滴下,可能的原因是__________________________________。
②装置B中生成Na2S2O3的同时也生成CO2,反应的离子方程式为______________________________。
③装置C是为了检验装置B中SO2的吸收效率,则C中的试剂为________________,当B中SO2的吸收效率低时,C中的现象为________________________,除搅拌和使用多孔球泡外,再写出一种提高B中SO2的吸收效率的方法:______________________________。
(2)预测并探究硫代硫酸钠的性质(反应均在溶液中进行):
预测 | 实验操作 | 实验现象 | |
探究1 | Na2S2O3溶液呈碱性 | _________ | pH=8 |
探究2 | Na2S2O3具有还原性 | 向新制氯水中滴加Na2S2O3 | ______ |
①探究1中的实验操作为________________________。
②探究2中的实验现象为_____________________,反应的离子方程式为_____________。
【答案】 Na2SO3+H2SO4==Na2SO4+H2O+SO2↑ 没有打开分液漏斗上的玻璃塞 2S2-+CO32-==3S2O32-+CO2↑ 品红溶液(或溴水或KMnO4溶液) C中溶液颜色较快褪去 控制SO2的流速(或适当升高B中溶液温度) 取一片pH试纸在玻璃片上,用洁净的玻璃棒蘸取待测液滴于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比 氯水颜色变浅,甚至褪去 S2O32-+4Cl2+5H2O=2SO42-+10H++8Cl-
【解析】本题主要考查对于实验室模拟工业硫化碱法制取硫代硫酸钠(Na2S2O3)并探究其性质实验的评价。
(1)①装置A中发生强酸硫酸制取弱酸亚硫酸的反应,反应的化学方程式为Na2SO3+H2SO4==Na2SO4+H2O+SO2↑。打开分液漏斗的活塞时,发现液体不能顺利滴下,可能的原因是没有打开分液漏斗上的玻璃塞,造成漏斗内气压小于大气压。
②装置B中生成Na2S2O3的同时也生成CO2,反应的离子方程式为2S2-+CO32-==3S2O32-+CO2↑。
③装置C是为了检验装置B中SO2的吸收效率,则C中的试剂为品红溶液(或溴水或KMnO4溶液),当B中SO2的吸收效率低时,C中的现象为C中溶液颜色较快褪去,除搅拌和使用多孔球泡外,另一种提高B中SO2的吸收效率的方法:控制SO2的流速(或适当升高B中溶液温度)。
(2)①探究1中的实验操作为取一片pH试纸在玻璃片上,用洁净的玻璃棒蘸取待测液滴于试纸的中部,观察变化稳定后的颜色,与标准比色卡对比。
②探究2中的实验现象为氯水颜色变浅,甚至褪去,反应的离子方程式为S2O32-+4Cl2+5H2O=2SO42-+10H++8Cl-。


科目:高中化学 来源: 题型:
【题目】关于0.1 mol/L醋酸钠溶液,下列说法正确的是
A. 加少量水稀释时,![]() 增大
增大
B. 向其中再加入少量醋酸钠晶体时,溶液中所有离子浓度都增大
C. 离子浓度大小比较:c(CH3COO-) >c(Na+) >c(OH-) > c(H+)
D. 向其中加入盐酸至恰好呈中性时,c(Na+) = c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)氯原子的结构示意图为_____________________。
(2)![]() 微粒中的质子数是_______,中子数是_______,核外电子数是_______。
微粒中的质子数是_______,中子数是_______,核外电子数是_______。
(3)49g硫酸的物质的量为________mol,其完全电离产生H+的个数为___________。
(4)V L Al2(SO4)3溶液中,含有a g Al3+,则溶液中Al3+的物质的量浓度_________;SO42— 物质的量浓度__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2H2(g)+O2(g)= 2H2O(g) ΔH=-483.6 kJ·mol-1
②H2(g) + S(g) = H2S(g) ΔH=-20.1 kJ·mol-1 。下列判断一定正确的是
A. 1 mol氢气完全燃烧生成H2O(g)吸收241.8 kJ热量
B. 水蒸气和硫化氢的能量相差221.7 kJ
C. 由①②知,水的热稳定性小于硫化氢
D. 反应②中改用固态硫,1 mol H2完全反应放热将小于20.1 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水得到的粗食盐水中常含Ca2+、Mg2+、SO42—![]() ,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂:①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中的Ca2+、Mg2+、SO42—
,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂:①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中的Ca2+、Mg2+、SO42—![]() 。提纯时的操作步骤和加入试剂的情况如图。
。提纯时的操作步骤和加入试剂的情况如图。

图中a、b、c、d分别表示上述4种试剂中的一种,请回答:
(1)沉淀A的名称是________。
(2)试剂d是________;判断试剂d已经足量的方法是____________________。
(3)加入b、c后溶液中发生的化学反应的化学方程式有__________________________(任写两个)。
(4)现有下列仪器,过滤出沉淀A、B、C时必须用到的是____(填序号),仪器③的名称是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):
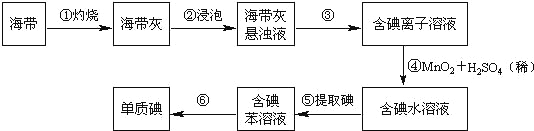
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_______(从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_______;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是_______。在分液操作中,应充分振荡,然后静置,待分层后________(填标号),以下略。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬和铜都是人体所必需的微量元素。回答下列问题:
(1)铬原子的最高能层符号是_______,其价层电子的轨道表达式(电子排布图)为_______。
(2) 比较第二电离能Cu______Zn(填“>”、“=”、“<"),理由是_________。
(3)铬的一种氧化物常温下呈蓝色,化学式为CrO5,已知该氧化物中铬为+6价,请写出CrO5的结构式___________。
(4)氧化亚铜溶于浓氨水中形成无色配离子[Cu(NH3)2]+,则该配离子中铜的化合价为________,杂化类型为_________。[Cu(NH3)2]2SO4中阴离子的立体构型是_________。
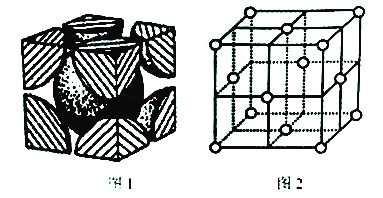
(5)已知图1为铬的晶胞结构图,则铬晶胞属于______堆积,晶跑中实际拥有的铬原子数为_______;图2是铜的晶胞结构图,若其立方晶胞参数为a nm,该晶胞中原子的体积占晶胞体积的百分率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
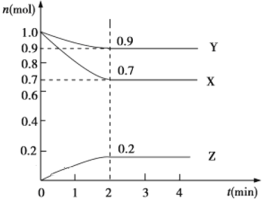
(1)起始时X的浓度为c(X)=________;反应从开始至2分钟末,Y的转化率为α(Y)=________;用Z的浓度变化表示0~2分钟内的平均反应速率为v(Z)=________。
(2)由图中所给数据进行分析,该反应的化学方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com