
| A. | 3.9gNa2O2固体中含有的阴离子数为0.05 NA | |
| B. | 标准状况下,2.24LCCl4所含原子数为0.5 NA | |
| C. | 1L 0.1mol/L醋酸溶液中含有的CH3COOH分子数为0.1 NA | |
| D. | 56g铁丝与一定量Cl2发生反应,当铁粉反应完全时,电子转移的数目可能为2.2 NA |
分析 A.根据过氧化钠的物质的量结合一个过氧化钠化学式中含有的阴离子个数计算总阴离子个数;
B.标准状况下四氯化碳不是气体;
C.醋酸是弱电解质存在电离平衡;
D.铁和氯气反应生成氯化铁,56g铁的物质的量为1mol,与足量氯气完全反应失去3mol电子;
解答 解:A.一个过氧化钠化学式中含有1个阴离子,3.9gNa2O2的物质的量=$\frac{3.9g}{78g/mol}$=0.05mol,所以含有的阴离子数是0.05 NA,故A正确;
B.标准状况下四氯化碳不是气体,2.24LCCl4所含物质的量不是0.1mol,原子数不是0.5 NA,故B错误;
C.1L 0.1mol/L醋酸溶液中,醋酸是弱电解质存在电离平衡,含有的CH3COOH分子数小于0.1 NA ,故C错误;
D.56g铁粉的物质的量为1mol,1mol铁与足量氯气完全反应失去3mol电子,转移电子数目为3NA,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,要求掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:实验题

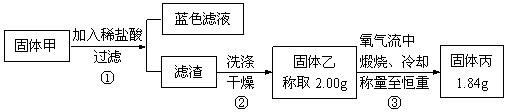
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)→2H2O(l)+Q1 2H2(g)+O2(g)→2H2O(g)+Q2 | |
| B. | S(g)+O2(g)→SO2(g)+Q1 S(s)+O2(g)→SO2(g)+Q2 | |
| C. | C(s)+0.5O2(g)→CO(g)+Q1 C(s)+O2(g)→CO2(g)+Q2 | |
| D. | H2(g)+Cl2(g)→2HCl(g)+Q1 $\frac{1}{2}{H_2}$(g)+$\frac{1}{2}C{l_2}$(g)→HCl(g)+Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KClO3(s)═2KCl(s)+3O2(g)△H=-78.03kJ•mol-1 △S=+1110 J•mol-1•K-1 | |
| B. | CO(g)═C(s,石墨)+$\frac{1}{2}$O2(g)△H=+110.5kJ•mol-1△S=-89.36 J•mol-1•K-1 | |
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)△H=-444.3kJ•mol-1△S=-280.1 J.mol-1•K-1 | |
| D. | NH4HCO3(s)+CH3COOH(aq)═CO2(g)+CH3COONH4(aq)+H2O(l)△H=+37.301kJ•mol-1△S=+184.05 J•mol-1•K-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl- | |
| B. | 含有大量OH-的溶液:Na+、Ca2+、SO42-、CO32- | |
| C. | 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN- | |
| D. | 含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l);△H=-57.4kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| C. | 已知反应2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ•mol-1,则H2的燃烧热为571.6kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1Ll.00mol•L-1NaCl溶浓中NaCl分子数为NA | |
| B. | 标准状况下,2.24L由N2和O2组成的混合气体中所含的原子数为0.1NA | |
| C. | 常温下,0.1molCl2溶于水时,转移的电子效是0.1NA | |
| D. | 0.lmolFe与过量稀HNO3反应时,转移的电子教为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
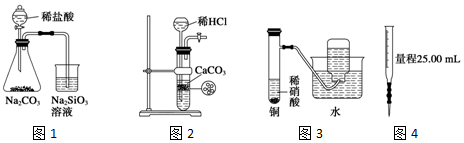
| A. | 图1为证明非金属性强弱:Cl>C>Si | |
| B. | 图2为制备少量CO2并控制反应 | |
| C. | 图3为制备并收集少量NO气体 | |
| D. | 图4量取0.10mol•L-1 KOH溶液20.00mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com