
将16g Cu与一定量的浓硫酸加热后,恰好完全反应,反应方程式如下:
Cu + 2H2SO4 (浓) CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
问:(1)得到SO2气体的体积(标准状况下)是多少?
(2)求被还原的硫酸质量
(3)把所得的CuSO4配制成500mL CuSO4 溶液,求所得溶液中溶质的物质的量浓度。
(1)5.6L;(2)24.5g;(3)0.5mol/L
【解析】
试题分析:(1)16g铜的物质的量为 =0.25mol,根据反应方程式Cu + 2H2SO4 (浓)
=0.25mol,根据反应方程式Cu + 2H2SO4 (浓) CuSO4 + SO2↑+ 2H2O故生成0.25mol二氧化硫,体积为0.25molx22.4L/mol=5.6L;(2)根据反应方程式得0.25molCu发生反应,被还原的硫酸的物质的量为0.25mol,质量为0.25molx98g/mol=24.5g;(3)0.25mol铜生成0.25mol硫酸铜,浓度为
CuSO4 + SO2↑+ 2H2O故生成0.25mol二氧化硫,体积为0.25molx22.4L/mol=5.6L;(2)根据反应方程式得0.25molCu发生反应,被还原的硫酸的物质的量为0.25mol,质量为0.25molx98g/mol=24.5g;(3)0.25mol铜生成0.25mol硫酸铜,浓度为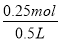 =0.5mol/L.答案为(1)5.6L;(2)24.5g;(3)0.5mol/L
=0.5mol/L.答案为(1)5.6L;(2)24.5g;(3)0.5mol/L
考点:物质的量的有关计算


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源:2014-2015学年辽宁大连市高一上期中考试化学试卷(解析版) 题型:选择题
为除去粗盐中Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.②④⑤①③
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高二上学期第一次月考化学试卷(解析版) 题型:选择题
Mg?AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:
2AgCl+Mg === Mg2++2Ag +2Cl-。有关该电池的说法正确的是( )
A.可用于海上照明供电 B.负极反应为AgCl+e-===Ag+Cl-
C.Mg为电池的正极 D.AgCl为阳极,发生了氧化反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列物质间的每一个转化,不能都通过一步反应实现的是
A.Ca→CaO→CaCl2B.NaOH→Na2CO3→NaCl
C.C→CO2→Na2CO3 D.O2→ CuO→Cu(OH)2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高一上学期第一次月考化学试卷(解析版) 题型:选择题
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O。对于该反应,下列说法正确的是
A.该反应是置换反应B.钾元素化合价降低
C.铁元素化合价不变D.该反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高一上学期期中考试化学试卷(解析版) 题型:填空题
(4分)有四种物质是:标准状况下有①6.72LCH4;②3.01x1023个HCl;③13.6gH2S;④0.2molNH3,它们中物质的量最大的是 ,所含分子数最多的是 ,含有原子数最多的是 ,质量最大的是 。(用序号填空)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高一上学期期中考试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.铁粉与稀盐酸反应Fe+2H+=Fe3++H2↑
B.少量金属钠放入冷水中:Na + 2H2O = Na++ 2OH- + H2↑
C.氧化铜溶于硫酸:O2―+2H+=H2O
D.碳酸钙溶于醋酸CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高二上学期9月培优复习化学试卷(解析版) 题型:填空题
已知:
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
H2CO3 | Ka1 = 4.2×10-7 | HClO | 3×10-8 |
Ka2 = 5.6×10-11 |
(1)用方程式表示HCN溶液显酸性的原因:______________________________。
(2)上述四种酸中,酸性最强的是 ;
(3)25℃时,0.01 mol/L NaCN溶液的pH________7;
(4)在浓度均为0.01 mol/L的CH3COONa、NaClO、Na2CO3的混合溶液中,逐滴加入0.01 mol/L HCl,则体系中酸根离子反应的先后顺序为 ;
(5)向pH=4的CH3COOH溶液中,加入下列物质,能使CH3COOH电离平衡向逆向移动的是:_________________。
①加入少量NH4Cl固体 ②加入等体积pH=5的盐酸
③加入少量Na2CO3固体 ④加入等体积0.01 mol/L的CH3COONa 溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com