
)镁铝合金在交通、航空、电子等行业有着广泛的应用。某化学兴趣小组试对镁铝合金废料进行回收利用,实验中可将铝转化为硫酸铝晶体,并对硫酸铝晶体进行热重分析。镁铝合金废料转化为硫酸铝晶体实验流程如下:
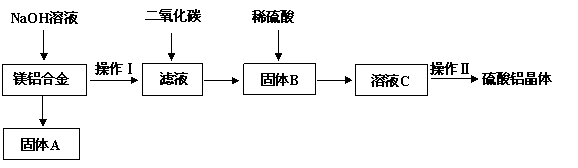
试回答下列问题:
(1)在镁铝合金中加入NaOH溶液,写出反应的化学反应方程式 ▲ ,固体B的化学式 ▲ 。
(2)操作Ⅱ包含的实验步骤有:蒸发浓缩、 ▲ 、 ▲ 、洗涤、干燥。
(3)操作Ⅱ中常用无水乙醇对晶体进行洗涤,选用无水乙醇的原因是 ▲ 。
(4)若初始时称取的镁铝合金废料的质量为9.00 g,得到固体A的质量为4.95 g,硫酸铝晶体的质量为49.95 g(假设每一步的转化率均为100%,合金废料中不含溶于碱的杂质)。计算得硫酸铝晶体的化学式为 ▲ 。
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K-523K,553K-687K,1043K以上不再失重,其热分解的TG曲线见下图,已知: 。
。
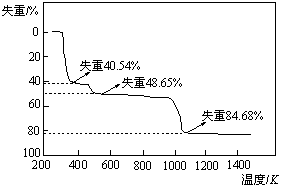 根据图示数据计算确定每步分解的产物,写
根据图示数据计算确定每步分解的产物,写
出第一阶段分解产物的化学式 ▲ ,第三阶段反应化学方程式 ▲ 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列说法中正确的是 ( )
A. 熵增加且吸热的反应一定是自发反应 B. 熵增加且放热的反应一定是自发反应
C. 熵减少且放热的反应一定是自发反应 D. 熵减少且吸热的反应一定是自发反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下表标出的是元素周期表的一部分元素,回答下列问题:
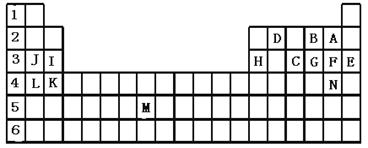 |
(1)表中用字母标出的15种元素中,化学性质最不活泼的是 (用元素符号表示,下同),金属性最强的是 ,非金属性最强的是 ,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)。
(2)B,F,C气态氢化物的化学式分别为 、 、 ,其中以 最不稳定。
(3)第三周期中原子半径最小的是 (稀有气体元素除外)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A. 甲烷与乙烯互为同系物 B. 32S与33S是同种核素
C. 正丁烷与异丁烷互为同素异形体 D. 乙醇和二甲醚(CH3-O-CH3)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C、D、E,原子序数依次增大。已知元素A的气态氢化物和A的最高价氧化物对应的水化物反应生成盐;B、E为同主族元素,B元素原子最外层电子数是次外层的3倍;D是地壳中含量最多的金属元素;C是短周期中与水反应最激烈的金属元素。下列叙述不正确的是
A.元素A的氧化物常温下一般均为无色无味气体
B.元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应
C.原子半径:C>D>B
D.元素B的气态氢化物的沸点比元素E气态氢化物的沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验“操作和现象”与“结论”都正确的是
| 操作和现象 | 结论 | |
| A | 切开金属钠,钠表面的银白色会逐渐褪去 | Na在空气中会生成Na2O2 |
| B | 铝箔插入浓硝酸中,无明显现象 | 铝与浓硝酸不反应 |
| C | 将FeCl2溶液滴加到少许酸性KMnO4溶液中,溶液褪色 | FeCl2具有漂白性 |
| D | 向Fe(NO3)2溶液中滴加稀硫酸和KSCN溶液,溶液变成红色 | 溶液中有Fe3+生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于Li、Na、K、Rb、Cs的叙述均正确的一组是
①金属性最强的是铯
②它们的氧化物都只有M2O和M2O2两种形式
③在自然界中均以化合态形式存在
④密度按Li—Cs顺序依次递增
⑤离子半径:Rb+>K+>Na+
A.①②③ B.①③④⑤ C.②④⑤ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与社会、生活密切相关,下列说法正确的是( )
A. 纳米材料直径一般在几纳米到几十纳米(1nm=10﹣9m)之间,因此纳米材料属于胶体
B. 青铜是我国使用最早的合金
C. SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆
D. 明矾与漂白粉都是水处理药品,原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
氨、甲烷都是重要的氢化物,按要求回答下列问题:
(1)NH3(g)和O2(g)反应生成NO(g)和H2O(g)的△H往往难以直接测量,从产物稳定性看,其主要原因是 .
已知:1molN2(g)反应生成2mol NH3(g)的△H=﹣92kJ•mol﹣1,1mol H2(g)燃烧生成H2O (g) 的△H=﹣242kJ•mol﹣1,1mol N2(g)和O2 (g)完全反应生成NO(g)的△H=+180kJ•mol﹣1.若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 .
(2)甲烷与水蒸气通入聚焦太阳能反应器,可发生反应的化学方程式为CH4+H2O⇌CO+3H2,该反应为吸热反应.已知在三种不同条件(Ⅰ、Ⅱ、Ⅲ)下,氢气的产量随时间的变化如图1所示.
①在0~20小时内,甲烷的反应速率vⅠ、vⅡ和vⅢ从大到小的顺序为 .
②将0.4mol甲烷和0.4mol水蒸气充入2L恒容的密闭容器中,某条件下反应达到平衡,测得氢气的物质的量浓度为0.3mol•L﹣1,则该条件下此反应的平衡常数K= ,甲烷的转化率为 .
③氢气的百分含量与体系总压强(P)、温度(T)的关系如图2所示.
平衡状态由A变到B时,对应的平衡常数:K(A) K(B)(填“>”、“<”或“=”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com