
【题目】氯水中存在平衡Cl2+H2O![]() HCl+HClO,HClO
HCl+HClO,HClO![]() H++ClO-。达平衡后,要使HClO浓度增大,可加入( )
H++ClO-。达平衡后,要使HClO浓度增大,可加入( )
A.H2SB.NaHCO3C.盐酸D.NaOH
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,五种短周期元素原子半径与原子序数的关系如图所示。
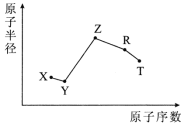
已知:TX2是现代光学及光纤制品的基本原料;
ZY 能破坏水的电离平衡;Z3RY6在工业上常用作助熔剂。
(1)R在元素周期表中的位置是___。
(2)上述元素中的某两种元素可组成一种五原子共价化合物,该化合物的结构式为___。
(3)请用一个化学方程式比较X和Y的非金属性的强弱_____。
(4)工业上以Z3RY6作助熔剂的目的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在接触法制硫酸和合成氨工业的生产过程中,下列说法错误的是()
A.硫铁矿在燃烧前要粉碎,目的是使硫铁矿充分燃烧,加快反应速率
B.二氧化硫的催化氧化反应的温度控制在450度左右,主要考虑到催化剂V2O5的活性温度
C.吸收塔中用98.3%的浓硫酸代替水吸收SO3,以提高效率
D.工业上为提高反应物N2、H2的转化率和NH3的产量和反应速率,常在合成氨反应达到平衡后再分离氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
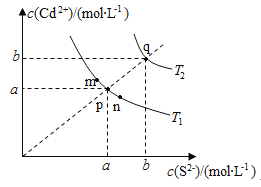
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下物质:
①明矾 ②一水合氨 ③碳酸氢钠 ④硫酸铁 ⑤硝酸钡 ⑥硝酸
请完成下列问题:
(1)属于弱电解质的是___________________;(选填编号)
(2)由于促进水的电离平衡而使溶液显酸性的是__________________;(选填编号)
(3)它们水溶液PH >7的有_________________;(选填编号)
(4)写出下列物质之间发生反应的离子方程式:
①+⑤__________________ ②+④___________________ ③+⑥__________________
(5)明矾溶于水后能净水,是由于Al3+水解后能形成Al(OH)3胶体,该胶体具有吸附性,请写出Al3+水解的方程式:____________________;
硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3ySO3zH2O),为测定某碱式硫酸铁的组成,取5.130g样品溶于足量盐酸中,然后加入过量的BaCl2溶液,经过滤、洗涤、干燥得白色固体5.825g,向上述滤液中加入过量的NaOH溶液,经过滤、洗涤、灼烧得到固体1.600g,该样品的化学式中x、y、z的值分别为_______________(填整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究铁在某浓度H3PO4和H2O2的混合溶液中反应的情况,进行如下实验:
实验 | 操作 | 现象 |
Ⅰ | 将除去氧化膜的铁钉置于烧杯中,加入30 mL 1.0 mol·L1 H3PO4和 3 mL 30% H2O2的混合溶液(pH≈1)。 | 一段时间后铁钉表面突然产生大量气泡,随后停止产生气泡;一段时间后再产生大量气泡,再停止,出现周而往复的现象。过程中,溶液保持澄清。
|
Ⅱ | 将与实验Ⅰ相同的铁钉放入烧杯中,加入30 mL 1.0 mol·L1H3PO4和3 mL H2O。 | 片刻后铁钉表面持续产生气泡,溶液保持澄清。 |
已知:Fe3(PO4)2难溶于水,Fe(H2PO4)2溶于水。
(1)用85% H3PO4配制100 mL 1.0 mol·L1H3PO4所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、______。
(2)实验Ⅱ中铁钉表面产生气体的化学方程式是______。
(3)探究停止产生气泡的原因。
提出假设:铁钉表面形成了含有+3价铁的氧化膜将铁钉覆盖。
甲同学进行实验Ⅲ,得出假设成立的结论。
实验Ⅲ:将洗净的实验Ⅰ中无气泡产生时的铁钉置于试管中,加入滴有KSCN溶液的稀H2SO4,振荡,静置,溶液呈红色。
乙同学认为实验Ⅲ无法证实假设成立,其理由是_____。
乙同学通过改进实验证实了假设成立。
(4)铁钉表面突然产生大量气泡的可能原因是Fe2+迅速被H2O2氧化形成氧化膜,使聚集在铁钉表面的H2脱离铁钉表面。
①实验Ⅳ证实了形成氧化膜过程中产生H+。
实验Ⅳ:______(填操作),滴入少量FeSO4溶液后,立即测定pH,pH迅速降低。
②形成氧化膜(以Fe2O3计)的离子方程式是______。
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率
角度分析其原因:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是______________。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是_________、_________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的是____________(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如表所示:
氧化物 | Li2O | MgO | P4O6 | SO2 |
熔点/°C | 1570 | 2800 | 23.8 | 75.5 |
解释MgO熔点比P4O6熔点高得多的原因______________
(4)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)
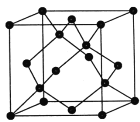
①碳化硅晶体(金刚砂)的化学式______________
②金刚石、晶体硅、碳化硅的熔点由高到低的顺序为__________________
③立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼的密度是_____________g/cm3(列出式子并化简,阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究苯与溴的取代反应,甲用下图装置Ⅰ进行如下实验:
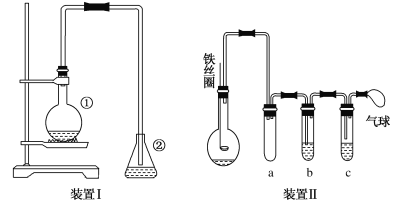
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑作催化剂,3~5分钟后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应。
(1)装置Ⅰ中①的化学方程式为__________________________。
(2)烧瓶中生成的红褐色油状液滴的成分是溴苯和溴单质,要想得到纯净的产物,可用NaOH溶液试剂洗涤。洗涤后分离粗产品应使用的仪器是________________。
(3)乙同学设计上图所示装置Ⅱ,并用下列某些试剂完成该实验。可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳。
a的作用是__________________。b中的试剂是___________________。比较两套装置,装置Ⅱ的主要优点__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com