
| A、强电解质溶液的导电能力一定比弱电解质强 |
| B、相同温度下,0.1mol?L-1 NH4Cl溶液中NH4+的浓度比0.1mol?L-1氨水中NH4+的浓度大 |
| C、盐酸中加入固体NaCl,因Cl-浓度增大,所以溶液酸性减弱 |
| D、冰醋酸是弱电解质,液态时能导电 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、X3YZ4 |
| B、X2YZ3 |
| C、XYZ4 |
| D、X4YZ4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.7% | B、8.6% |
| C、15.5% | D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5:1 | B、2:1 |
| C、1:3 | D、1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol?L-1 |
| B、0.4mol?L-1 |
| C、0.8mol?L-1 |
| D、1.6mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 |
| B、加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+2c(SO32-) |
| C、加入一定量的蒸馏水,溶液中c(H+) 和c(OH-)都减少 |
| D、加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、NO3-、Fe2+、Cl- |
| B、Fe3+、SO42-、Mg2+、OH- |
| C、Na+、SO32-、NO3-、H+ |
| D、HCO3-、NH4+、H+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
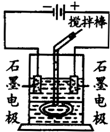 在玻璃圆筒中盛有两种无色的互不相溶的中性液体.上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以上下搅动液体,装置如图.接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成.停止通电,取出电极,用搅拌棒上下剧烈搅动.静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色.
在玻璃圆筒中盛有两种无色的互不相溶的中性液体.上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅拌棒,可以上下搅动液体,装置如图.接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成.停止通电,取出电极,用搅拌棒上下剧烈搅动.静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com