
某可逆反应为2X(g) 3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:
3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:
下列推断正确的是( )。
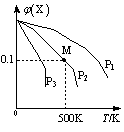
A.升高温度,该反应平衡常数K减小
B.压强大小有P3>P2>P1
C.平衡后加入高效催化剂使Mr增大
D.在该条件下M点X平衡转化率为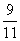
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大。A是宇宙中含量最高的元素,B可形成多种同素异形体,其中一种的硬度自然界中最大。D元素原子的最外层电子数是次外层电子数的3倍。E元素的最高价氧化物的水化物的酸性强于硫酸。
(1)写出元素C在元素周期表的位置 ,单质E的工业制备的离子方程式为________。
(2)B、C、D三种元素的最简单氢化物的稳定性从大到小的顺序是 (填化学式),
B的单质,在加热条件下能与C的最高价氧化物对应的水化物的浓溶液反应,写出对应的化学方程式 。
(3)A、B、C、D几种元素之间可以形成多种10电子微粒,写出上述10电子微粒中离子之间反应的一个离子方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
300 mL 0.2 mol/L KCl溶液与100 mL 0.3 mol/L AlCl3溶液中Cl-物质的量浓度之比是( )A.1∶3 B.2∶3 C.2∶1 D.2∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、R属于短周期主族元素。X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m—n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1。 下列叙述错误的是:( )
A.X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
B.Y的氢化物比R的氢化物稳定,熔沸点高
C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z
D.RY2、WY2通入BaCl2溶液中均有白色沉淀生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示。下列说法正确的是:( )
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如下图所示。下列说法正确的是:( )
A. A、B两点表示在某时刻达到平衡状态,
此时A、B两点时容器中,n(A)总∶n(B)总= 4∶5
B. A、C两点都表示达到平衡状态,则自反应开始到达
平衡状态所需的时间tA<tC
C. 设B、C两点的平衡常数分别为KB、KC,则KB<KC
D. 在不改变反应物用量的情况下,降温、加压、
将甲醇从混合体系中分离出来均可提高CO的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
目前,消除氮氧化物污染有多种方法。
⑴用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+4NO2 (g)=4NO(g)+CO2 (g)+2H2 O(g) ΔH=-574 kJ·mol-1
②CH4 (g)+4NO(g)=2N2 (g)+CO2 (g)+2H2 O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式__________
⑵用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
| 浓度/mol·L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
①不能作为判断反应达到化学平衡状态的依据是_______
A.容器内CO2的浓度保持不变 B.v正(N2)=2 v正(NO)
C.容器内压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在该温度下时.该反应的平衡常数为 (保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是_______。
⑶合成塔失去活性的铬锌触媒可用于制备锌锰电池。在碱性条件下,该电池的总反应为:
Zn(s) +2MnO2 (s) +H2O(l) = Zn(OH)2 (s) +Mn2O3(s) ,该电池正极的电极反应式是
。PbO2 可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ,阴极上观察到的现象是; 若电解液中不加入Cu(NO3)2这样做的主要缺点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是 ( )
①将CO2通入溶有足量氨的BaCl2溶液中,无白色沉淀生成
②将盐酸、KSCN溶液和Fe(NO3)2溶液三种溶液混合,混合溶液显红色
③向某溶液中滴入盐酸酸化的BaCl2溶液产生白色沉淀,证明溶液中一定含有SO42-
④将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后按入水中,两者放出的氢气质量相等
A.只有② B.①②③ C.①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
酒精和醋酸是生活里的常用品,下列方法不能将二者鉴别开的是( )
|
| A. | 闻气味 |
|
| B. | 分别用来浸泡水壶中的水垢看是否溶解 |
|
| C. | 分别滴加NaOH溶液 |
|
| D. | 分别滴加石蕊试液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com