
A.FeCl3+3NH4SCN Fe(SCN)3+3NH4Cl溶液显红色,加少量NH4Cl固体后颜色变浅 Fe(SCN)3+3NH4Cl溶液显红色,加少量NH4Cl固体后颜色变浅 |
| B.红棕色NO2加压后颜色先变深后变浅 |
| C.SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| D.H2、I2、HI平衡混和气加压后颜色变深 |
 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)+2D(g)达到平衡状态的是
2C(g)+2D(g)达到平衡状态的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
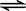 2AB3(g)在可变容器中不能作为达到平衡的标志是
2AB3(g)在可变容器中不能作为达到平衡的标志是| A.容器内每减少1mol A2,同时消耗2mol AB3 |
| B.容器内nA2:nB2:nAB3=1:3:2 |
| C.混合气体总的物质的量 |
| D.容器内的气体密度不再改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
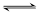 2NH3,下列说法正确的是
2NH3,下列说法正确的是| A.增加N2的量,可以加快反应速率 |
| B.当N2和H2全部转化为NH3时,反应达到最大限度 |
| C.达到平衡时,H2和NH3的浓度比一定为3∶2 |
| D.分别用N2和NH3来表示该反应的速率时,数值大小相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 B(g),下列各项中,表示已达到平衡的是:
B(g),下列各项中,表示已达到平衡的是:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3Z(g)。下列说法不正确的是
3Z(g)。下列说法不正确的是| A.容器内压强不随时间变化而变化 |
| B.某一时刻,容器内各物质的浓度有可能相等 |
| C.达到平衡时,单位时间内生成3n mol Z,同时生成 2n mol Y |
| D.X,Y的转化率相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO2(g)+O2(g) 平衡时,容器内有0.6 molSO2,其平衡常数约是
2SO2(g)+O2(g) 平衡时,容器内有0.6 molSO2,其平衡常数约是| A.0.68 | B.0.34 | C.0.45 | D.0.47 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 c C(g)+d D(g) △H = -Q kJ/mol(Q为正值),达平衡状态后,下列结论中不正确的是
c C(g)+d D(g) △H = -Q kJ/mol(Q为正值),达平衡状态后,下列结论中不正确的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com