
(15分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
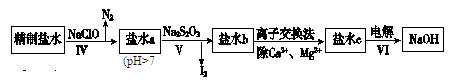
(1)① 取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明Fe 3+已除尽;反之没除尽(2分)
③ 2Mg2++2CO32-+H2O=Mg2(OH)2CO3↓+CO2↑(3分)
④Ba2+(2分)
(2)① NH4+、I-(2分)
② 5S2O32-+8IO3-+2OH-=4I2+10SO42-+H2O(3分)
③阴极H+放电,促进水的电离, OH-浓度增大,Na+向阴极区移动,生成NaOH(2分)
解析试题分析:(1)①检测Fe3+是否除尽用KSCN溶液。②根据表中数据可以看出:BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完全。③除去Mg2+的离子方程式:2Mg2++2CO32-+H2O=Mg2(OH)2CO3↓+CO2↑。④根据表格中部分沉淀及其溶解度,可以看出BaCO3溶解度最大,则检测Ca2+、Mg2+、Ba2+是否除尽时,只需检验Ba2+,即可。
(2)①过程Ⅳ加入NaClO,是强碱弱酸盐,同时NaClO具有强氧化性,故能氧化NH4+、I-分别生成氮气和碘,即除去的离子为NH4+、I-。
②Na2S2O3将IO3-还原为I2,生成硫酸根离子、碘单质等,根据氧化还原反应方程式和离子方程式的配平方法,离子方程式为:5S2O32-+8IO3-+2OH-=4I2+10SO42-+H2O。
③过程VI中,电解NaCl溶液,在电解槽的阴极区电极反应为:2H++2e-=H2↑,即,阴极H+放电,促进水的电离,OH-浓度增大,Na+向阴极区移动,生成NaOH。
考点:考查常见离子的检验、氧化还原反应及电化学等知识。


科目:高中化学 来源: 题型:单选题
下图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
| | M | N | P |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸溶液 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铁 | 硝酸铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)如图所示3套实验装置,分别回答下列问题。
(1)装置1中的Cu是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象。
① 电源的M端为 极
② 乙烧杯中电解反应的离子方程式 。
(3)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理装置3所示。
①请写出A、B两处物质的名称:A___________________B____________________
②请写出电解食盐水的离子方程式__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlClx-SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2↑。请回答下列问题:
(1)电池的负极材料为 ,发生的电极反应为 。
(2)电池正极发生的电极反应为 。
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 。
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分)(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中,正极电极反应式为_________________,发生 反应(填氧化或还原);电子从 经外电路到 (填锌或铜),溶液中H+ 向 移动(填正极或负极)。
(2)根据反应2Fe3+ + Cu = 2Fe2++Cu2+ 设计原电池,所需负极材料为 ,溶液中Fe3+向 (填“负极”或“正极”)迁移,负极反应式为 ;正极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)(1)为了验证Fe3 +与Cu2+氧化性强弱,下列装置能达到实验目的的是___________
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
①_______处电极入口通甲烷(填A或B),其电极反应式为_______________________________
_________________________________________
②当消耗甲烷的体积为22.4L(标准状况下)时, 假设电池的能量转化率为100%,则导线中转移电子的物质的量为 ,消耗KOH的物质的量为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)(1)甲烷通常用来作燃料,其燃烧反应的化学方程式是 。
(2) 若用甲烷—氧气构成燃料电池,电解质溶液为KOH溶液,试写出该电池的正极的电极反应式 ;负极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4 ( g ) + H2O ( g )=CO ( g ) + 3H2 ( g ) △H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g )=CH3OH ( g ) △H=—129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用右图装置模拟上述过程:
①写出阳极电极反应式 。
②写出除去甲醇的离子方程式 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的电极负极反应式,负极: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(1)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为:H2+2NiOOH 2Ni(OH)2
2Ni(OH)2
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH (填“增大”、“减小”或“不变”),该电极的电极反应式为 。
(2)Cu2O是一种半导体材料,可通过如图的电解装置制取,电解总反应为:2Cu+H2O Cu2O+H2↑
Cu2O+H2↑
阴极的电极反应式是 。
用镍氢电池作为电源进行电解,当蓄电池中有1 mol H2被消耗时,Cu2O的理论产量为 g。
(3)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的 腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的 (填“正”或“负”)极相连。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com