
下列各项不正确的是
A.等物质的量浓度的下列溶液中① NH4Al(SO4)2 ② NH4Cl,③CH3COONH4,④ NH3·H2O;? c(NH4+),由大到小的顺序是①>②>③>④
B.室温下,向0.01mol/L? NH4HSO4溶液中滴加NaOH溶液至中性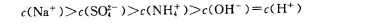
C.25℃时,0.1mol/LCH3COOH溶液V1 mL和0.1mol/L NaOH溶液V2mL混合,若V1>V2,则混合溶液的pH一定小于7
D.对于反应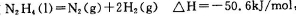 ,在任何温度下都能自发进行
,在任何温度下都能自发进行
C
【解析】
试题分析:A.NH3·H2O是若电解质,电离的程度是很微弱的。其余的都是盐,完全电离,因此④的C(NH4+)最小。② 在NH4Cl中存在水解平衡:NH4++H2O NH3·H2O+H+。在①中除了存在NH4+的水解平衡外,还存在Al3+的水解。Al3+ +3H2O
NH3·H2O+H+。在①中除了存在NH4+的水解平衡外,还存在Al3+的水解。Al3+ +3H2O Al(OH)3(胶体)+3H+。二者水解的酸碱性相同,对NH4+的水解起抑制作用,使铵根水解消耗的比②少些。因此c(NH4+):①>②.在③CH3COONH4中除了存在NH4+的水解平衡外,还存在CH3COO-的水解。CH3COO- +H2O
Al(OH)3(胶体)+3H+。二者水解的酸碱性相同,对NH4+的水解起抑制作用,使铵根水解消耗的比②少些。因此c(NH4+):①>②.在③CH3COONH4中除了存在NH4+的水解平衡外,还存在CH3COO-的水解。CH3COO- +H2O CH3COOH+OH-。二者水解的酸碱性相反,对NH4+的水解起促进作用,使铵根水解消耗的比②多些。因此c(NH4+):②>③.所以c(NH4+)大小顺序为:①>②>③>④。正确。B.室温下,向0.01mol/L? NH4HSO4溶液中滴加NaOH溶液至中性,发生反应:NH4HSO4+NaOH=NaNH4SO4+H2O。若恰好发生该反应,则由于NH4+的水解溶液显酸性。所以NaOH要稍微过量一些。所以离子浓度关系为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)。正确。C.25℃时,0.1mol/LCH3COOH溶液V1 mL和0.1mol/L NaOH溶液V2mL混合,若V1=V2恰好完全反应,则由于醋酸是弱酸,得到的盐是强碱弱酸盐。盐电离产生的CH3COO-水解消耗水电离产生的H+,使溶液显碱性,若酸CH3COOH稍微过量一些,即V1>V2,可以抑制CH3COO-水解,使其水解程度小些,如果酸的电离作用等于盐的水解程度,则pH=7;若酸的电离作用>盐的水解程度,则pH<7;如果酸的电离作用<盐的水解程度,则pH>7;因此 V1>V2时,混合溶液的pH不一定小于7。错误。D.由于反应N2H4(l)=N2(g)+2H2(g)?H=-50.6 KJ/mol,是个体系混乱程度增大的放热反应,?G=?H-T?S<0,所以在任何温度下都能自发进行。正确。
CH3COOH+OH-。二者水解的酸碱性相反,对NH4+的水解起促进作用,使铵根水解消耗的比②多些。因此c(NH4+):②>③.所以c(NH4+)大小顺序为:①>②>③>④。正确。B.室温下,向0.01mol/L? NH4HSO4溶液中滴加NaOH溶液至中性,发生反应:NH4HSO4+NaOH=NaNH4SO4+H2O。若恰好发生该反应,则由于NH4+的水解溶液显酸性。所以NaOH要稍微过量一些。所以离子浓度关系为c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)。正确。C.25℃时,0.1mol/LCH3COOH溶液V1 mL和0.1mol/L NaOH溶液V2mL混合,若V1=V2恰好完全反应,则由于醋酸是弱酸,得到的盐是强碱弱酸盐。盐电离产生的CH3COO-水解消耗水电离产生的H+,使溶液显碱性,若酸CH3COOH稍微过量一些,即V1>V2,可以抑制CH3COO-水解,使其水解程度小些,如果酸的电离作用等于盐的水解程度,则pH=7;若酸的电离作用>盐的水解程度,则pH<7;如果酸的电离作用<盐的水解程度,则pH>7;因此 V1>V2时,混合溶液的pH不一定小于7。错误。D.由于反应N2H4(l)=N2(g)+2H2(g)?H=-50.6 KJ/mol,是个体系混乱程度增大的放热反应,?G=?H-T?S<0,所以在任何温度下都能自发进行。正确。
考点:考查离子浓度的大小比较、盐的水解、酸的电离及反应自发性的判断的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2010-2011学年上海市嘉定区高三上学期第一次质量调研化学试卷 题型:选择题
有四组同族元素的物质,在101.3 kPa时测定它们的沸点(℃)如下表所示:
|
第一组 |
He -268. 8 |
(a) -249.5 |
Ar -185.8 |
Kr -151.7 |
|
第二组 |
F2 -187.0 |
Cl2 -33.6 |
(b) 58.7 |
I2 184.0 |
|
第三组 |
(c) 19.4 |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
第四组 |
H2O 100.0 |
H2S -60.2 |
(d) -42.0 |
H2Te -1.8 |
下列各项中正确的是
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质中C的沸点最高,是因为C分子的式量最大
D.第四组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te
查看答案和解析>>
科目:高中化学 来源:2010年温州市高一下学期期末统一测试化学试题 题型:选择题
有四组同族元素的物质,在101.3 kPa时测定它们的沸点(℃)如下表所示:
|
第一组 |
He -268.8 |
(a) -249.5 |
Ar -185.8 |
Kr -151.7 |
|
第二组 |
F2 -187.0 |
Cl2 -33.6 |
(b) 58.7 |
I2 184.0 |
|
第三组 |
(c) 19.4 |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
第四组 |
H2O 100.0 |
H2S -60.2 |
H2Se -42.0 |
H2Te -1.8 |
下列各项中正确的是
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质中C的沸点最高,是因为C分子内存在氢键
D.第四组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
 mol/L
mol/L查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com