
| A. | CO2的电子式 | B. | Cl2的结构式:Cl-Cl | ||
| C. | CH4的球棍模型 | D. | Clˉ离子的结构示意图  |
分析 A.二氧化碳为共价化合物,含有C=O键;
B.氯气存在Cl-Cl键;
C. 为比例模型;
为比例模型;
D.Clˉ离子的原子核外有3个电子层,最外层电子数为8.
解答 解:A.二氧化碳为共价化合物,含有C=O键,电子式为 ,故A正确;
,故A正确;
B.氯气存在Cl-Cl键,结构式为Cl-Cl,故B正确;
C.甲烷为正四面体结构,甲烷的球棍模型为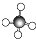 ,故C错误;
,故C错误;
D.Clˉ离子的原子核外有3个电子层,最外层电子数为8,离子的结构示意图 为 ,故D正确.
,故D正确.
故选C.
点评 本题综合考查化学用语,为高频考点,题目侧重考查电子式、离子结构示意图、球棍模型等知识,难度不大,注意掌握电子式、分子式、结构简式、结构式的概念及区别,明确球棍模型与比例模型的表示方法.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液为澄清状态 | |
| B. | 反应后溶液中AlO2-浓度为0.1 mo L•L-1 | |
| C. | 反应后溶液中离子浓度最大的是Cl- | |
| D. | 溶液中Al3+与AlO2-浓度之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| C. | 随着元素原子序数的递增,原子半径从小到大(稀有气体除外)重复出现 | |
| D. | 随着元素原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强重复出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 试剂1 | 试剂2 | 操作及现象 |
| ① | 铜丝 | 氯气 | 将加热后的铜丝伸入盛有氯气的集气瓶中,产生棕黄色的烟 |
| ② | 稀硝酸 | 产生无色气体,遇空气变为红棕色 | |
| ③ | 0.1mol/LKMnO4溶液 | 加热后,铜丝表面有黑色物质,溶液颜色无明显变化 |

| 环境 | 反应现象 |
| 酸性 | 溶液紫红色变浅 |
| 碱性(1mL 1mol/L NaOH溶液) | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该混合物一定是K2CO3和NaCl | B. | 该混合物可能是Na2CO3和KCl | ||
| C. | 该混合物可能是Na2SO4和Na2CO3 | D. | 该混合物一定是Na2CO3和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸光照逐渐变黄,说明光照分解生成的有色产物能溶于其中 | |
| B. | 中和滴定时,眼睛应注视滴定管中的液面下降 | |
| C. | 向饱和FeCl3溶液中滴加过量氨水,可制得Fe(OH)3胶体 | |
| D. | 配制一定物质的量浓度的溶液时,应将刚溶解后的溶液立即转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com