
����Ŀ�������軯�أ�K4[Fe(CN)6]���׳ƻ�Ѫ�Σ�������ˮ�ͱ�ͪ����ʳ�ε�һ�ֿ�������ú�NaCN��N��-3�ۣ��ķ�Һ�ϳɻ�Ѫ�ε���Ҫ����������ͼ��

��1��ʵ������NaCN��������NaCN��Һʱ��Ӧ�Ƚ�������____��Һ����������ˮϡ�͡�
��2��������ͼ����Ӧ�����з�������Ҫ��Ӧ�ķ���ʽΪ_______________��
��3�������м���̼������Һ��ҪĿ���dz�ȥ__________��
��4����ͬ�¶����ܽ�ȣ�Na4[Fe(CN)6]____K4[Fe(CN)6]��ѡ�������=����
��5���ҹ��������涨ʳ���л�Ѫ�����ʹ����Ϊ10 mg/kg����Ѫ�ο������Ը��������Һ��Ӧ��K4[Fe(CN)6]+KMnO4+H2SO4��KHSO4+Fe2(SO4)3+MnSO4+HNO3+CO2+H2O��δ��ƽ��������1molK4[Fe(CN)6]�������������ĸ�����ص����ʵ���Ϊ____��
��6�������ʱ�����Һ����ֱ������������Һ���ɽ���ת��ΪK4[Ag2(CN)6]��Һ��д��AgCl���Ѫ����Һ��ȡ���Һ�����ӷ���ʽ_________________��
���𰸡� �������� 6NaCN+FeSO4+CaCl2= Na4[Fe(CN)6]+ CaSO4��+2NaCl Ca2+ �� 12.2mol 2AgCl+[Fe(CN)6]4-=Fe2++[Ag2(CN)6]2-+2 Cl-
��������ʵ��Ŀ���Ǻϳɻ�Ѫ�Σ������̿�֪��NaCN��Һ�м��������������Ȼ��ƣ�����6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6+CaSO4��+2NaCl��Ȼ�����̼������Һ�ɳ�ȥ������Ca2+�������˺�����Һ�м���KCl��ת������K4[Fe(CN)6��˵��K4[Fe(CN)6�ܽ�Ƚ�С��
(1)NaCNˮ��ʼ��ԣ�Ϊ����ˮ�⣬��������Һʱ�ɽ����ܽ�������������Һ�У��ڼ�ˮϡ�ͣ��ʴ�Ϊ��NaOH��
(2)NaCN��Һ�м��������������Ȼ��ƣ�����6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6+CaSO4��+2NaCl���ʴ�Ϊ��6NaCN+FeSO4+CaCl2=Na4[Fe(CN)6+CaSO4��+2NaCl��
(3)��Ӧ���м����Ȼ��ƣ�����̼������Һ�ɳ�ȥ������Ca2+���ʴ�Ϊ��Ca2+��
(4)�����˺�����Һ�м���KCl��ת������K4[Fe(CN)6��˵��K4[Fe(CN)6�ܽ�Ƚ�С���ʴ�Ϊ������
(5)1mol K4Fe(CN)6�������������ʱ��Fe���ϼ���+2�����ߵ�+3�ۣ�NԪ�ػ��ϼ���-3�����ߵ�+5�ۣ�CԪ�ػ��ϼ���+2�����ߵ�+4�ۣ���Fe��N��C�Ļ��ϼ�������1+6��(8+2)=61�ۣ���ʧȥ61mol���ӣ�����������е���Ԫ�ش�+7��Ϊ+2�ۣ���õ�5mol���ӣ����ݵ����غ㣬1mol K4Fe(CN)6��������������������ĸ�����ص����ʵ���Ϊ12.2mool���ʴ�Ϊ��12.2��
(6)���Һ����ֱ������������Һ���ɽ���ת��ΪK4[Ag2(CN)6]��AgCl���Ѫ����ȡ���Һ�ɽ���ת��ΪK4[Ag2(CN)6]����Ӧ�����ӷ���ʽΪ��2AgCl+[Fe(CN)6]4-=Fe2++[Ag2 (CN)6]4-+2Cl-���ʴ�Ϊ��2AgCl+[Fe(CN)6]4-=Fe2++[Ag2(CN)6]4-+2Cl-��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ԫ����H2A����ˮ�еĵ��뷽��ʽ��H2A=H++HA-��HA-![]() H++A2-��
H++A2-��
��1��Na2A��Һ��_________����������������������������������������__________�������ӷ���ʽ��ʾ����
��2����֪0.1mol/L��NaHA��Һ��pH=2,��0.1mol/L��H2A��Һ��c��H+ ��_______������<����>������=����0.11mol/L��
��3����0.1mol/L��Na2A��Һ�У�������Ũ�ȹ�ϵʽ����ȷ����__������ĸ����
A.c��A2- ��+c��HA-��=0.1mol/L
B.c��OH-��=c��H+�� +c��HA-��
C.c��Na+��+c��H+��=c��OH-��+c��HA-��+c��A2-��
D.c��Na+��=2c��A2-��+2c��HA-��
��4������0.1mol/L��H2A��Һ�м���������Ũ�ȵ�NaOH��Һ������Һ�и�����Ũ���ɴ�С��˳��Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����( )
A.����������һ�����н�����
B.�ں��������ӵĻ�����ľ����У�һ������������
C.�������۵��Ӳ���ɽ��������н������������ɵ��Ӽ������ǿ������
D.Ti������ԭ�Ӷѻ���ʽΪ�����������ܶѻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в����ھ������Ե��ǣ� ��
A.���й���ļ�������B.���и�������C.���жԳ���D.û�й̶����۵�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӿ�����Ǿ���ĽǶȷ�������ͨ������ˮ���ĸ��������ǣ� ��
A.���β�һ��
B.��ͨ�����Ļ������������������У�ˮ���Ļ����������ӳ���������������
C.ˮ���й̶����۵㣬��ͨ�����̶����۵�
D.ˮ������������ת������ͨ����������������ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڵ������Һ���ж���ȷ���ǣ� ��
A. 60��ʱ��NaCl��Һ��pH<7������Һ������
B. ��pH��4��CH3COOH��Һ��ˮϡ�ͣ���Һ���������ӵ�Ũ�Ⱦ���С
C. �����£�CH3COOH���ӿ��ܴ�����pH>7�ļ�����Һ��
D. ��ͬ�¶��£�1 mol��L��1��ˮ��0��5 mol��L��1��ˮ��c(OH��)֮����2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧʽֻ��ʾһ�ִ�������� ( )
A. C3H8 B. C4H10 C. C2H4Br2 D. C3H6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N4���ӽṹΪ�������壨��ͼ��ʾ������֪������N4(g)��1 molN-N������193kJ�������γ�N2(g)��1 mol N![]() N�ų�941 kJ����������˵����ȷ����
N�ų�941 kJ����������˵����ȷ����
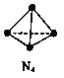
A. N4(g)��N2(g)���ȶ�
B. N4(g)=2N2(g) ��H=+724kJmol-1
C. �γ�1 mol N4(g)�еĻ�ѧ���ų�193 kJ������
D. lmolN2(g)��ȫת��ΪN4(g)����ϵ����������362kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������K2FeO4�������ּ�ǿ������������Ӧ��������ˮ�������乤ҵ�Ʊ�������ͼ��ʾ��

��1�������������Ԫ�صĻ��ϼ���__________�ۡ�
��2����ӦI��Ŀ����________________________________��
��3����ӦII�����ӷ���ʽΪ________________________________��
��4��ϴ�Ӵ�Ʒʱѡ���Ҵ�������ˮ��������________________________________��
��5����֪���ɸ�����صķ�ӦΪNa2FeO4+2KOH![]() K2FeO4��+2NaOH��������ͼ��뱥��KOH��Һ�����ɸ�����ص�������_________________________��
K2FeO4��+2NaOH��������ͼ��뱥��KOH��Һ�����ɸ�����ص�������_________________________��
��6��Ϊ�����������ˮ��������������ˮ����ʹ�ø��������K2FeO4�����������������Լ�����ˮ�ʣ�������ԭ����______________________��
��7�������Ǹ����εζ����ⶨ������غ������ζ�ʱ�йط�Ӧ�����ӷ���ʽΪ��
��FeO42-+CrO2-+2H2O==CrO42-+Fe(OH)3��+OH-
��2CrO42-+2H+=CrO72-+H2O
��CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
�ֳ�ȡ2.084g���������Ʒ��������NaOH��Һ�У������Թ�����NaCrO2����ַ�Ӧ����ˣ���Һ��250mL����ƿ�ж��ݡ�ÿ��ȡ25.00mL����ϡ�����ữ����0.1000mol��L-1��FeSO4����Һ�ζ������εζ����ı���Һ��ƽ�����Ϊ20.00mL����������Ʒ��K2FeO4 ����������Ϊ______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com