
| 滴定次数 | 标准溶液体积/mL | 待测溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20.00 | 1.50 | 23.70 |
| 2 | 20.00 | 1.02 | 21.03 |
| 3 | 20.00 | 2.00 | 21.99 |
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另外加少量MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
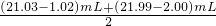 =20mL,令KMnO4溶液的浓度为cmol/L,由2KMnO4~5H2C2O4可知:20mL×cmol/L=
=20mL,令KMnO4溶液的浓度为cmol/L,由2KMnO4~5H2C2O4可知:20mL×cmol/L= ×20mL×0.250mol/L,解得c=0.100;
×20mL×0.250mol/L,解得c=0.100; V(H2C2O4)?c(H2C2O4),即c(KMnO4)=
V(H2C2O4)?c(H2C2O4),即c(KMnO4)=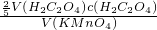
 V(H2C2O4)?c(H2C2O4),即c(KMnO4)=
V(H2C2O4)?c(H2C2O4),即c(KMnO4)=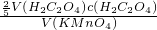 ,据此分析判断;
,据此分析判断;

 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
 Fe2++Ag+,请回答下列问题:
Fe2++Ag+,请回答下列问题: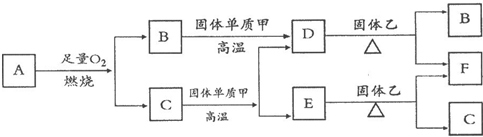
查看答案和解析>>
科目:高中化学 来源:河北省冀州中学2010-2011学年高二下学期第三次月考化学试题 题型:058
(1)菠菜营养丰富,素有“蔬菜之王”之称,在营养价值上是一种高效的补铁剂.某化学小组欲设计实验方案,探究菠菜中是否存在铁元素与草酸及可溶性草酸盐.甲同学查阅资料得知:草酸又名乙二酸,化学式为H2C2O4,是一种二元有机弱酸,具有较强的还原性.甲同学依据上述信息推测,菠菜中铁元素呈________价,其理由是________.甲同学同时设计实验方案,验证其推测是否正确.请简述实验方案________.
(2)乙炔是有机合成工业的一种原料.工业上曾用![]() 与水反应生成乙炔.
与水反应生成乙炔.
①CaC2中![]() 与
与![]() 互为等电子体,
互为等电子体,![]() 的电子式可表示为________;1 mol
的电子式可表示为________;1 mol ![]() 中含有的
中含有的![]() 键数目为________.
键数目为________.
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型是________;分子中处于同一直线上的原子数目最多为________.
查看答案和解析>>
科目:高中化学 来源:2012届河北省高二下学期第三次月考化学卷 题型:填空题
(11分)(1)菠菜营养丰富,素有“蔬菜之王”之称,在营养价值上是一种高效的补铁剂。某化学小组欲设计实验方案,探究菠菜中是否存在铁元素与草酸及可溶性草酸盐。甲同学查阅资料得知:草酸又名乙二酸,化学式为H2C2O4,是一种二元有机弱酸,具有较强的还原性。甲同学依据上述信息推测,菠菜中铁元素呈 价,其理由是 。甲同学同时设计实验方案,验证其推测是否正确。请简述实验方案 。
(2)乙炔是有机合成工业的一种原料。工业上曾用 与水反应生成乙炔。
与水反应生成乙炔。
① 中
中 与
与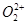 互为等电子体,
互为等电子体,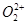 的电子式可表示为
;1mol
的电子式可表示为
;1mol 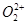 中含有的
中含有的 键数目为_ 。
键数目为_ 。
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为_ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(11分)(1)菠菜营养丰富,素有“蔬菜之王”之称,在营养价值上是一种高效的补铁剂。某化学小组欲设计实验方案,探究菠菜中是否存在铁元素与草酸及可溶性草酸盐。甲同学查阅资料得知:草酸又名乙二酸,化学式为H2C2O4,是一种二元有机弱酸,具有较强的还原性。甲同学依据上述信息推测,菠菜中铁元素呈 价,其理由是 。甲同学同时设计实验方案,验证其推测是否正确。请简述实验方案 。
(2)乙炔是有机合成工业的一种原料。工业上曾用与水反应生成乙炔。
①中
与
互为等电子体,
的电子式可表示为 ;1mol
中含有的
键数目为_ 。
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为_ 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年河北省冀州中学高二下学期第三次月考化学卷 题型:填空题
(11分)(1)菠菜营养丰富,素有“蔬菜之王”之称,在营养价值上是一种高效的补铁剂。某化学小组欲设计实验方案,探究菠菜中是否存在铁元素与草酸及可溶性草酸盐。甲同学查阅资料得知:草酸又名乙二酸,化学式为H2C2O4,是一种二元有机弱酸,具有较强的还原性。甲同学依据上述信息推测,菠菜中 铁元素呈 价,其理由是 。甲同学同时设计实验方案,验证其推测是否正确。请简述实验方案 。
铁元素呈 价,其理由是 。甲同学同时设计实验方案,验证其推测是否正确。请简述实验方案 。
(2)乙炔 是有机合成工业的一种原料。工业上曾用
是有机合成工业的一种原料。工业上曾用 与水反应生成乙炔。
与水反应生成乙炔。
① 中
中 与
与 互为等电子体,
互为等电子体, 的电子式可
的电子式可 表示为 ;1mol
表示为 ;1mol  中含有的
中含有的 键数目为_ 。
键数目为_ 。
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为_ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com