
| A、在铜与硫的反应中,1mol铜失去的电子数为NA |
| B、标准状况下,11.2LSO3所含硫原子数为0.5NA |
| C、由2H和18O所组成的水11g,其中所含的中子数为4NA |
| D、1molCl2与足量的水反应,转移的电子数为2NA |
| m |
| M |
| 11g |
| 22g/mol |


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
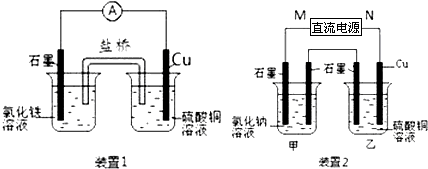
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验目的 | |
| A | 制乙炔时用饱和食盐水代替水 | 加快化学反应速率 |
| B | CH4与C2H4混合气体通过盛有溴水的洗气瓶 | 除去中CH4的C2H4 |
| C | 淀粉溶液水解后冷却至室温,加碘水观察现象 | 检验淀粉是否完全水解 |
| D | 将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验溴乙烷中的溴原子 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
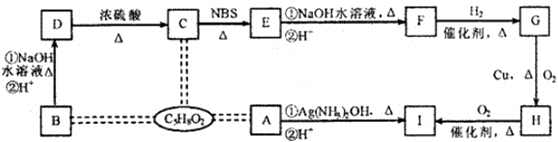
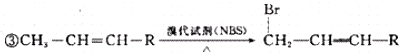
查看答案和解析>>
科目:高中化学 来源: 题型:
 |
1.5 |
2.5 |
3.0 |
3.5 |
4.0 |
| 830℃ |
0.481 |
0.575 |
0.626 |
0.669 |
0.685 |
| 890℃ |
0.579 |
0.691 |
0.694 |
0.669 |
0.669 |
950℃ |
0.669 |
0.714 |
0.714 |
0.714 |
0.714 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com