
 一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g)+H2O (g)?CO2(g)+H2 (g)△H<0
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g)+H2O (g)?CO2(g)+H2 (g)△H<0| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
分析 (1)根据v=$\frac{△c}{△t}$计算v(CO),再利用速率之比等于化学计量数之比计算v(CO2);
(2)①t1℃时,3min处于平衡状态,根据K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$计算平衡常数;
t1℃时平衡时CO浓度为0.1mol/L,大于850℃平衡时CO的浓度,说明t1℃与850℃相比平衡逆向移动,正反应为放热反应,升高温度平衡逆向移动;
②反应在4min~5min间,CO、H2O浓度均增大0.016mol/L,CO2的浓度减小0.016mol/L,平衡逆向移动,等于化学计量数之比,正反应为气体体积不变的放热反应,可能是增大氢气浓度,或升高温度.
解答 解:(1)由图可知,4min内CO浓度变化量为(0.2-0.08)mol/L=0.12mol/L,故v(CO)=$\frac{0.12mol/L}{4min}$=0.03mol/(L.min),速率之比等于化学计量数之比,则v(CO2)=v(CO)=0.03mol/(L.min),
故答案为:0.03mol/(L.min);
(2)①t1℃时,3min处于平衡状态,则:
CO(g)十H2O(g)?CO2(g)十H2 (g)
起始(mol/L):0.20 0.30 0 0
转化(mol/L):0.1 0.1 0.1 0.1
平衡(mol/L):0.1 0.2 0.1 0.1
故平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.1×0.1}{0.1×0.2}$=0.5,
t1℃时平衡时CO浓度为0.1mol/L,大于850℃平衡时CO的浓度,说明t1℃与850℃相比平衡逆向移动,正反应为放热反应,升高温度平衡逆向移动,故t1℃>850℃,
故答案为:0.5;大于;正反应为放热反应;
②反应在4min~5min间,CO、H2O浓度均增大0.016mol/L,CO2的浓度减小0.016mol/L,平衡逆向移动,等于化学计量数之比,正反应为气体体积不变的放热反应,改变压强或使用催化剂不影响平衡移动,可能是增大氢气浓度,或升高温度,
故答案为:向左;b.
点评 本题考查化学平衡计算与影响因素,是对学生综合能力的考查,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题

| A. | △H>0,m+n>x+y | B. | △H<0,m+n>x+y | C. | △H<0,m+n>x | D. | △H>0,m+n<x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
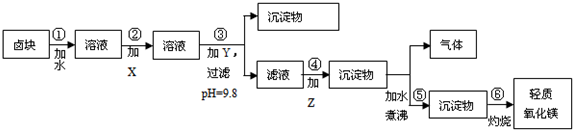
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6* |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 物质 | 价格(元•吨-1) |
| 漂液(含25.2% NaClO) | 450 |
| 双氧水(含30% H2O2) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
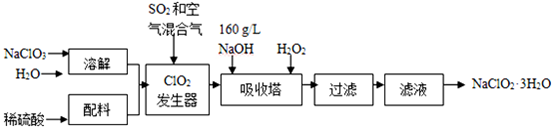
| 步骤I | 称取样品w g配成溶液置于锥形瓶中,并调节pH≤2.0 |
| 步骤II | 向锥形瓶中加入足量KI 晶体,充分搅拌,并加入少量指示剂 |
| 步骤III | 用c mol/L的Na2S2O3溶液滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 点e的正反应速率比点d的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不同 | |
| D. | 在给定条件下,t1、t2时刻NH3的含量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | p(N2)>p(H2)>p(HCl) | B. | p(HCl)>p(N2)>p(H2) | C. | p(H2)>p(HCl)>p(N2) | D. | p(H2)>p(N2)>p(HCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱-碱 硫化氢-酸 小苏打-酸式盐 | |
| B. | 碘酒-混合物 胆矾-纯净物 臭氧-单质 | |
| C. | 葡萄糖-电解质 CO2-酸性氧化物 蛋白质溶液-胶体 | |
| D. | 氨水-电解质 硫酸钡-非电解质 酒精-有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C4H8 | D. | C2H4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com