
分析 根据甲苯好高锰酸钾之间的反应,可以得到苯甲酸,苯甲酸具有酸性,可以和氢氧化钠之间反应得到苯甲酸钠,根据信息(2),苯基酸钠在强碱氢氧化钠的作用下,可以发生减短碳链的反应得到苯,据此回答.
解答 解:根据甲苯好高锰酸钾之间的反应,可以得到苯甲酸,即5C6H5CH3+6KMnO4+9H2SO4→5C6H5-COOH+3K2SO4+6MnSO4+14H2O,苯甲酸具有酸性,可以和氢氧化钠之间反应得到苯甲酸钠,即C6H5-COOH+NaOH=C6H5COONa+H2O,根据信息(2),苯基酸钠在强碱氢氧化钠的作用下,可以发生减短碳链的反应得到苯,即C6H5COONa+NaOH→C6H6+Na2CO3.
故答案为:5C6H5CH3+6KMnO4+9H2SO4=5C6H5-COOH+3K2SO4+6MnSO4+14H2O、C6H5-COOH+NaOH=C6H5COONa+H2O、C6H5COONa+NaOH=C6H6+Na2CO3.
点评 本题涉及物质的性质以及信息的应用和物质的合成知识,注意知识的归纳和梳理是解题的关键,难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案科目:高中化学 来源: 题型:填空题
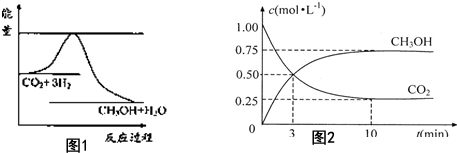 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ•mol-1)的变化.(已知气体物质的量增加是熵变大的过程)
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ•mol-1)的变化.(已知气体物质的量增加是熵变大的过程)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
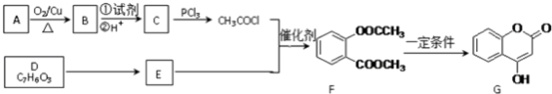
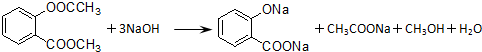 .
.
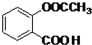 .
.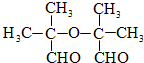 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
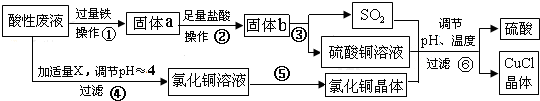
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$
 +2H2C=CH2$\stackrel{一定条件}{→}$
+2H2C=CH2$\stackrel{一定条件}{→}$
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com