
【题目】工业上用含有少量氧化铁杂质的废铜粉为原料,制取硫酸铜的主要过程如下图所示: 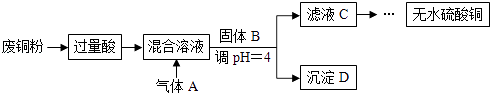
下列有关说法不正确的是( )
A.“过量酸”不适合用硝酸或浓硫酸,固体B可以用CuO、Cu(OH)2或Cu2(OH)2CO3
B.通入的气体A可以是O2或Cl2
C.通入气体A之前的混合溶液中存在的阳离子是:Fe2+、Cu2+、H+
D.将从溶液中得到的硫酸铜晶体在空气中加热,可制得无水硫酸铜
【答案】B
【解析】解:因制备硫酸铜,废铜屑应加入稀硫酸中,稀硫酸、铜和氧化铁反应是氧化铁和稀硫酸反应生成硫酸铁和水,硫酸铁和铜反应生成氯化亚铁和氯化铜;气体A应为空气,通入热的空气是为了氧化亚铁离子为三价铁离子,调整溶液PH除去铁离子,沉淀D为氢氧化铁,C为硫酸铜溶液,蒸发结晶可得到硫酸通过晶体,A.不适合用硝酸,易生成硝酸铜而引入新杂质,加入浓硫酸,发生氧化还原反应生成二氧化硫气体,污染环境,固体B可以用CuO、Cu(OH)2或Cu2(OH)2CO3 , 目的是调整溶液pH除去铁离子,且不引入新杂质,故A正确;
B.不能通入氯气,否则生成氯化铜,引入新杂质,故B错误;
C.稀硫酸、铜和氧化铁反应是氧化铁和稀硫酸反应生成硫酸铁和水,硫酸铁和铜反应生成氯化亚铁和氯化铜,反应的离子方程式为:Fe2O3+6H+═2Fe3++3H2O、2Fe3++Cu═2Fe2++Cu2+ , 反应离子方程式为:4Fe2++4H++O2═4Fe3++2H2O,混合溶液中存在的阳离子是:Fe2+、Cu2+、H+ , 故C正确;
D.硫酸铜晶体在空气中加热可失去结晶水,生成硫酸铜,故D正确.
故选B.
因制备硫酸铜,废铜屑应加入稀硫酸中,稀硫酸、铜和氧化铁反应是氧化铁和稀硫酸反应生成硫酸铁和水,硫酸铁和铜反应生成氯化亚铁和氯化铜;气体A应为空气,通入热的空气是为了氧化亚铁离子为三价铁离子,调整溶液pH除去铁离子,沉淀D为氢氧化铁,C为硫酸铜溶液,蒸发结晶可得到硫酸通过晶体,以此解答该题.


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由Cu、Zn作电极与CuSO4溶液组成的原电池中Cu是负极
C.马口铁(镀锡铁)破损时与电解质溶液接触,锡先被腐蚀
D.铜锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题.
元素 | 性质或结构信息 |
A | 单质制成的高压灯,发出的黄光透雾力强、射程远.且其单质燃烧后生成淡黄色固体 |
B | 工业上通过分离液态空气获得其单质.原子的最外层电子数是内层电子总数的2.5倍 |
C | 单质是双原子分子,常温、常压下是淡黄绿色气体,原子的L层再增加一个电子即达到稳定结构 |
D | +2价阳离子的核外电子排布与氖原子相同 |
(1)上表中与A属于同一周期的元素是(写元素符号) , 画出D离子的结构示意图 .
(2)已知C的单质能与H2O发生置换反应生成O2 , 写出C单质与水反应的化学方程式
(3)对元素B的单质或化合物描述正确的是 . a.B元素的最高正价为+6 b.常温、常压下单质难溶于水
c.单质分子中含有18个电子 d.在一定条件下氢气能与单质B反应
(4)A和D两元素活泼性较强的是(写元素名称) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1.00L 1.00molL﹣1H2SO4溶液与2.00L 1.00molL﹣1 NaOH溶液完全反应,放出114.6kJ热量,该反应的中和热△H为_____,表示其中和热的热化学方程式为_____.
(2)在25℃、101KPa时,1.00g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8kJ的热量,C6H6的燃烧热为_____KJmol﹣1,该反应的热化学方程式为_____.
(3)化合物AX3和单质X2在一定条件下反应可生成化合物AX5.回答下列问题:
已知AX3的熔点和沸点分别为﹣93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成1mol AX5,放出热量123.8kJ.该反应的热化学方程式为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次增大的同周期元素,已知A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的次外层电子数比最外层电子数多4个,E元素原子最外层与最内层电子数的差是3,试回答:
(1)写出下列元素的元素符号:ACD_E .
(2)用电子式表示B和F形成化合物的过程: .
(3)D在周期表中的位置 , E的氢化物中化学键类型是 , 比较D与E氢化物的稳定性(用化学式填空);
(4)写出C、F两种元素最高价氧化物的水化物相互反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是( )
A. 乙烯通入酸性高锰酸钾溶液中 B. 苯与液溴混合后撒入铁粉
C. 在镍作催化剂条件下,苯与氢气的反应 D. 乙烯通入溴水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠的说法中正确的是( )
A. 钠的含氧化合物都是碱性氧化物
B. 金属钠久置空气中最终转变为Na2O2
C. 钠可以将钛、铌等金属从其熔融的氯化物中置换出来
D. 过氧化钠只具有氧化性不具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关操作不可能引发喷泉现象的是:

A. 挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹
B. 挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C. 打开止水夹,用鼓气装置从装置③的a处不断鼓入空气
D. 向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是元素周期表的一部分,根据给定的元素回答下列问题
(1)K的元素符号是;
(2)D元素的外围电子排布图是 , 在其化合物中,最高正价是;
(3)C元素的原子结构示意图是;
(4)A与L、B与L都分别能形成原子个数比为1:1的化合物,A与L(1:1)的化合物是分子(填极性或非极性),B与L(1:1)的化合物的电子式是;
(5)G、H、L原子的第一电离能由高到低的顺序是(填元素符号);
(6)J单质的一种白色同分异构体的空间构型是;
(7)E元素在元素周期表中的位置是 , 在其化合物中,常有+2、+3价的2种离子,+3的离子比较稳定,其原因是;
(8)A与B的化合物的熔点比A与L的化合物的熔点高,其原因是;
(9)A的单质与L的单质与B的最高价氧化物的水化物溶液能组成燃烧电池,写出该种电池的负极的电极反应式;
(10)F元素的最高价氧化物与M元素的最高价氧化物的水化物反应的化学方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com