
| A. | CaCl2 Na2O H2O | B. | H2O Na2O2 CO2 | ||
| C. | MgCl2 NaOH NH4Cl | D. | H2SO4 H2O CO2 |
分析 离子化合物中含有离子键,共价化合物中只含有共价键,一般金属元素与非金属元素之间形成离子键,非金属元素与非金属元素之间形成共价键,据此分析.
解答 解:A.CaCl2、Na2O都是离子化合物,存在的化学键都是离子键,H2O是共价化合物,只存在共价键,故A错误;
B.H2O、CO2都是共价化合物,存在的化学键都是共价键,Na2O2是离子化合物,存在的化学键是离子键,故B错误;
C.MgCl2是离子化合物,存在的化学键都是离子键,NaOH、NH4Cl是离子化合物,存在的化学键都是离子键和共价键,故C错误;
D.H2SO4 H2O CO2都是共价化合物,存在的化学键都是共价键,故D正确;
故选D.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:实验题
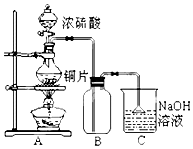 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | |||
| 方案② |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯乙烯分子的结构简式:H3C-CH2Cl | B. | 硫原子的结构示意图: | ||
| C. | 过氧化钠的电子式: | D. | 中子数为10的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ②③ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 还原性:Na+>S2->Br->Cl- | ||
| C. | 热稳定性:PH3>H2S>HCl>HF | D. | 水溶液酸性:HF>HCl>HBr>HI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com