
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池可长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应为Zn-2e-+2OH-=Zn(OH)2
B.充电时阳极反应为Fe(OH)3-3e-+5OH-=FeO![]() +4H2O
+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】在一定量的密闭容器中,充入浓度分别为0.20mol·L-1、0.10mol·L-1 SO2和O2,发生反应:2SO2(g)+O2(g)2SO3(g)。当反应达到平衡时,不可能存在的数据是
A.SO2为0.10 mol·L-1B.O2为0.05mol·L-1
C.SO2为0 mol·L-1D.SO3为0.15 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶A和盛有潮湿有色布条的广口瓶B,可观察到的现象是__,发生该现象的原因___。(试用离子方程式和简单文字解释)
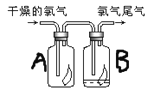
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用__溶液吸收多余的氯气,原理是___(用化学方程式表示)。
(3)根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是__(填化学式),长期露置于空气中的漂白粉会变质,变质后的漂白粉加稀盐酸后产生的气体是__(用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】理论上不能设计为原电池的化学反应是,注:△H<0为放热反应
A.CH4(g)+2O2(g)![]() CO2(g)+2H2O(l);△H<0
CO2(g)+2H2O(l);△H<0
B.HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(aq);△H<0
C.2H2(g)+O2(g)![]() 2H2O(g);△H<0
2H2O(g);△H<0
D.2FeCl3(l)+Fe(s)==3FeCl2(l);△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较给出![]() 能力的相对强弱:
能力的相对强弱:![]() ________
________![]() (填“>”“<”或“=”);用一个化学方程式说明
(填“>”“<”或“=”);用一个化学方程式说明![]() 和
和![]() 结合
结合![]() 能力的相对强弱________。
能力的相对强弱________。
(2)![]() 是离子化合物,各原子均满足8电子稳定结构。写出
是离子化合物,各原子均满足8电子稳定结构。写出![]() 的电子式________。
的电子式________。
(3)在常压下,甲醇的沸点(65℃)比甲醛的沸点(-19℃)高。主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大力发展电动汽车,可以有效控制空气污染.目前机动车常使用的电池有铅蓄电池、锂电池等.
Ⅰ![]() 铅蓄电池充放电的总反应为:
铅蓄电池充放电的总反应为:![]()
![]()
![]() ,锂硫电池充放电的总反应为:
,锂硫电池充放电的总反应为:![]()
![]()
![]() .
.
![]() 放电时,铅蓄电池的负极反应式为 ______ .
放电时,铅蓄电池的负极反应式为 ______ .
![]() 锂硫电池工作时,电子经外电路流向 ______
锂硫电池工作时,电子经外电路流向 ______ ![]() 填“正极”或“负极”
填“正极”或“负极”![]() .
.
![]() 当消耗相同质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的 ______ 倍.
当消耗相同质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的 ______ 倍.
Ⅱ![]() 由方铅矿
由方铅矿![]() 制备铅蓄电池电极材料
制备铅蓄电池电极材料![]() 的方法如下:
的方法如下:

![]() 油画所用的白色颜料
油画所用的白色颜料![]() 置于空气中,遇
置于空气中,遇![]() 气体变成黑色PbS,从而使油画的色彩变暗,用
气体变成黑色PbS,从而使油画的色彩变暗,用![]() 清洗,可使油画“复原”.
清洗,可使油画“复原”.
![]() 的作用是 ______.
的作用是 ______.
![]() 已知硫化铅溶于水时存在溶解平衡:
已知硫化铅溶于水时存在溶解平衡:![]() ,试分析
,试分析![]() 能溶于稀
能溶于稀![]() 的原因 ______.
的原因 ______.
![]() 滤液X是一种可循环使用的物质,其溶质主要是 ____
滤液X是一种可循环使用的物质,其溶质主要是 ____ ![]() 填化学式
填化学式![]() ,若X中残留的
,若X中残留的![]() 过多,循环使用时可能出现的问题是 ____.
过多,循环使用时可能出现的问题是 ____.
![]() 与次氯酸钠溶液反应可制得
与次氯酸钠溶液反应可制得![]() ,写出该反应的离子方程式 ______ .
,写出该反应的离子方程式 ______ .
![]() 以石墨为电极,电解
以石墨为电极,电解![]() 溶液也可以制得
溶液也可以制得![]() ,则阳极的电极反应式为 ______ ;电解时为提高Pb元素的利用率,常在
,则阳极的电极反应式为 ______ ;电解时为提高Pb元素的利用率,常在![]() 溶液中加入适量
溶液中加入适量![]() ,理由是 ______ .
,理由是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、CuCl是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜
、CuCl是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜![]() 含杂质
含杂质![]() 为原料,一种制备铜的氯化物的流程如下:
为原料,一种制备铜的氯化物的流程如下:
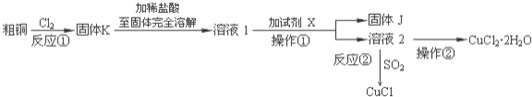
(1)上述流程中固体K溶于稀盐酸的目的是 ______ ![]() 试剂X、固体J的物质分别为 ______ .
试剂X、固体J的物质分别为 ______ .
A.NaOH![]() B.CuO
B.CuO![]() C.
C.![]()
![]()
![]()
![]()
(2)反应②是向溶液2中通入一定量的![]() ,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式 ______ .
,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式 ______ .
(3)以石墨为电极,电解![]() 溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式 ______ .
溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用饱和氯化钠溶液润湿的滤纸分别做甲、乙两个实验,下列判断错误的是
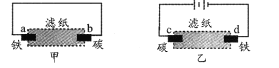
A. 甲是原电池,乙是电解池
B. 甲中铁棒比乙中铁棒更易腐蚀
C. d电极上的电极反应是:Fe-2e → Fe2+
D. b电极上的电极反应是:O2 + 2H2O + 4e → 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种金属单质和甲、乙、丙三种气体,及物质D、E、F、G、H,它们之间能发生如图所示变化(图中有些反应的产物和反应的条件没有全部标出)。请回答下列问题:
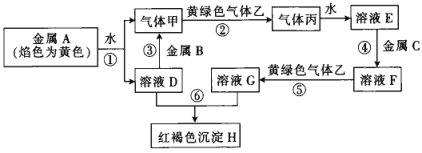
(1)写出指定物质的化学式:D____________、G____________、丙____________。
(2)上述反应中既是化合反应,又是氧化还原反应的是____________(填序号)。
(3)写出反应①的离子方程式:____________________________________。
(4)写出反应⑤的离子方程式________________________。用于检验溶液G中金属阳离子的试剂是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com