

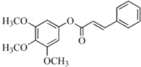
 ;
; ,
,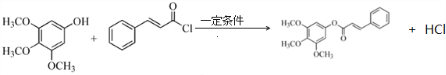 ,
, ;
; 或
或  ,
, 或
或  .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、铁为负极,锌为正极 |
| B、铁为阳极,锌为阴极 |
| C、用可溶性铁盐作电解液 |
| D、锌元素既被氧化又被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Cl2与足量NaOH反应,转移的电子数为2nA |
| B、1 mo1Na被完全氧化生成Na2O2,失去的电子数为2nA |
| C、常温常压下,22.4LSO2气体中含有的原子数小于3nA |
| D、0.1 mol/LNaOH溶液中含有Na+的数目为0.1 nA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
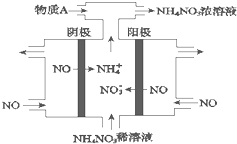 (1)室温下,向Na2S的水溶液中加入等体积等浓度的盐酸,反应后所得的溶液中,除氢离子之外的离子浓度由小到大的顺序为:
(1)室温下,向Na2S的水溶液中加入等体积等浓度的盐酸,反应后所得的溶液中,除氢离子之外的离子浓度由小到大的顺序为:查看答案和解析>>
科目:高中化学 来源: 题型:
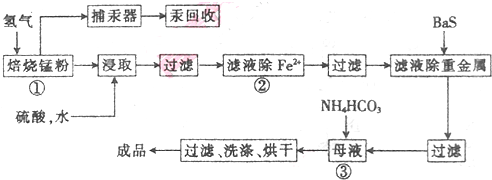
查看答案和解析>>
科目:高中化学 来源: 题型:
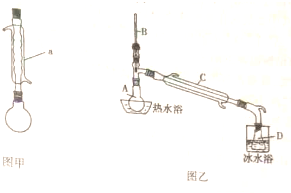
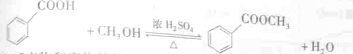
| 沸点/°C | 密度/g?cmˉ3 | 水中溶解性 | |
| 苯甲酸 | 249 | 1.2659 | 微溶于水 |
| 甲醇 | 64.6 | 0.7910 | 易溶于水 |
| 苯甲酸甲酯 | 198 | 1.0900 | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2在反应中是还原剂 |
| B、每摩尔Na2O2完全反应时转移电子1mol |
| C、反应中O2既是氧化产物,又是还原产物 |
| D、上述反应可用于潜水艇中提供氧气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com