
分析 (1)结合n=$\frac{m}{M}$、c=$\frac{n}{V}$及物质构成计算;
(2)结合结合n=$\frac{m}{M}$、V=nVm及分子构成计算.
解答 解:(1)MgCl2的摩尔质量是95g/mol,现取19.0gMgCl2固体溶于水配成2L的溶液,其中含Mg2+的浓度为$\frac{\frac{19.0g}{95g/mol}}{2L}$=0.1mol/L,Cl-的浓度为0.1mol/L×2=0.2mol/L,
故答案为:95g/mol;0.1mol/L;0.2mol/L;
(2)64g氧气含有$\frac{64g}{32g/mol}$×NA=2NA个氧分子,4NA个氧原子,它在标准状况下的体积为$\frac{64g}{32g/mol}$×22.4LL/mol=44.8L,
故答案为:2NA;4NA;.44.8L.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:填空题
 利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:
利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
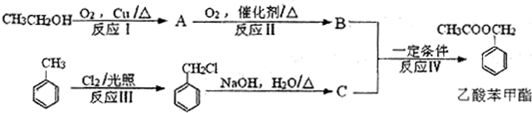
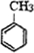 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl.
+HCl. 不能发生的化学反应是b(填序号).
不能发生的化学反应是b(填序号).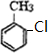 (写出一种即可).
(写出一种即可).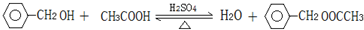 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 以石墨作电极电解饱和氯化钠溶液:2Cl-+2H2O$\stackrel{电解}{→}$ 2OH-+H2↑+Cl2↑ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+→Fe3++3H2O | |
| C. | H218O中投入少量Na2O2固体:2H218O+2O22-→4OH-+18O2↑ | |
| D. | CuCl2溶液中加入NaHS溶液:Cu2++HS-→CuS↓+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁与盐酸反应放出氢气 | B. | 氢氧化钠与盐酸的反应 | ||
| C. | 浓硫酸与蔗糖混合 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com