
向CH3COONa稀溶液中加入(或通入)少许X物质,其溶液中部分微粒浓度变化如下表所示(溶液温度不变):则X物质可能为( )
| 微粒 | H+ | OH- | CH3COO- | CH3COOH |
| 物质的量浓度 | 减小 | 增大 | 增大 | 减小 |
A.氯化氢 B.氢氧化钠 C.蒸馏水 D.醋酸
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
某实验小组的同学对电化学原理进行了一系列探究活动
⑴如图为某实验小组依据氧化还原反应:(用离子方程式表示) 设计的原电池装置,反应前,两电极质量相等,一段时间后,两电极质量相差18g,则导线中通过 mol电子。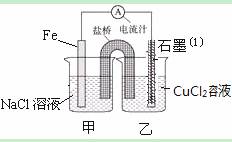
⑵用胶头滴管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式 ,然后滴加几滴硫氰化钾溶液,溶液变红;继续滴加过量新制饱和氯水,红色褪去,假设之一是“溶液中的+3价铁被氧化为更高的价态”。如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式 。
⑶如图其它条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,石墨⑴为 极(填 “正”、“负”、“阴”或 “阳”)。在甲装置中滴加几滴酚酞试液,振荡均匀,一段时间后,在甲装置中观察到 电极(填“铁”或“铜”)附近溶液先变红,该电极的反应式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)===H2(g)+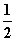 O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+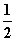 O2(g)===H2O(g) ΔH=242 kJ·mol-1
O2(g)===H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对氨水溶液中存在的电离平衡NH3·H2O
 NH
NH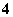 +OH-叙述正确的是( )
+OH-叙述正确的是( )
A.加水后,溶液中n(OH-)增大
B.加入少量浓盐酸,溶液中[OH-]增大
C.加入少量浓NaOH溶液,电离平衡正向移动
D.加入少量NH4Cl固体,溶液中[NH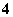 ]减少
]减少
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是在一定温度下,向不同电解质溶液中加入新物质时溶液的导电性能发生变化,其电流强度(I)随新物质加入量(m)的变化曲线,以下四个导电性实验,其中与A图变化趋势一致的是__________,与B图变化趋势一致的是__________,与C图变化趋势一致的是________。
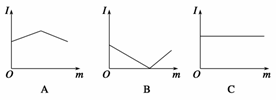
①氢氧化钡溶液中滴入硫酸溶液至过量;
②醋酸溶液中滴入氨水至过量;
③澄清石灰水中通入CO2至过量;
④氯化铵溶液中逐渐加入适量氢氧化钠固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.酸式盐的溶液一定显酸性
B.只要酸与碱的物质的量浓度和体积分别相同,它们反应后的溶液就呈中性
C.纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子的物质的量浓度相等
D.碳酸溶液中氢离子物质的量浓度是碳酸根离子物质的量浓度的二倍
查看答案和解析>>
科目:高中化学 来源: 题型:
3t℃时,水的离子积为 Kw,该温度下将a mol/L一元酸HA与b mol/L一元碱 BOH等体积混合,若混合后溶液呈中性,下列说法一定正确的是( )
A.混合液中,=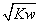 B.混合液的pH=7
B.混合液的pH=7
C.a=b D.混合液中,c(B+)=c(A-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的化学式是( )
A.NH3·D2O和HD2O+ B.NH3·HDO和D3O+ C.NH2D·D2O和DH2O+ D.NH2D·HDO和D3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、 池和结晶池。
②工业上通常以NaCl 、CO2 和 NH3 为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式:
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
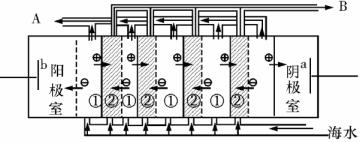
ⅰ电渗析法淡化海水中阴极室可获得的重要化工原料有
ⅱ上图中虚线部分表示 离子交换膜。 淡水从 (A或B) 排出。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
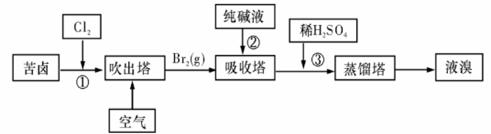
ⅰ写出反应③的离子方程式为: 。
ⅱ通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液?
ⅲ向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com