
【题目】Ⅰ.如图所示为常见玻璃仪器的部分结构:
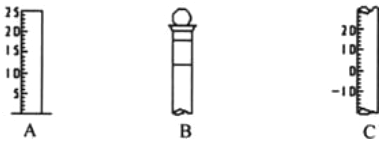
(1)请写出所列仪器的名称: A______,B_______,C_______;
(2)仪器 B 使用前必须__________________。
(3)仪器 B 上标记有________(填序号);①质量 ②温度 ③刻度线 ④浓度 ⑤容积
II.已知某“84 消毒液”瓶体部分标签如图所示,该“84 消毒液”通常稀释 100 倍(体积之比)后使用。请回答下列问题:
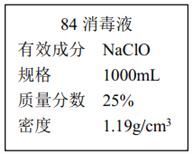
(1)该“84 消毒液”的物质的量浓度约为___mol·L-1。保留两位有效数字)
(2)某同学取100 mL该液”,稀释后用于消毒,稀释后的溶液中 c (Na+)=_____ mol·L-1。
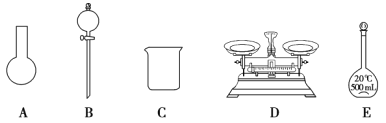
(3)该同学参阅该“84 消毒液”的配方,欲用 NaClO 固体配制 250 mL含 NaClO 质量分数为 25%的消毒液。下列说法不正确的是________(填序号)。
a.如图所示的仪器中,有三种是不需要的,还需要其它玻璃仪器
b.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
c.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
(4) “84 消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 98%(密度为1.84g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1 的稀硫酸用于增强“84 消毒液”的消毒能力。需用浓硫酸的体积为___mL。
【答案】量筒 容量瓶 温度计 检查是否漏水 ②③⑤ 4.0 0.04 ab 250
【解析】
I.(1)根据仪器的图形可知:A为量筒,B为容量瓶、C为温度计;
(2)B为容量瓶,容量瓶在使用前必须要检查是否漏水;
(3)容量瓶上标记有:温度、刻度线、容积,故填②③⑤;
II.(1)该“84 消毒液”的物质的量浓度c(NaClO)=![]() ≈4.0mol/L。
≈4.0mol/L。
(2)稀释前c(NaClO)=c(Na+)=4.0mol/L,稀释100倍后,c(Na+)=0.04mol/L。
(3)用 NaClO 固体配制 250 mL含 NaClO 质量分数为 25%的消毒液,即配制250mL4.0mol/L的NaClO溶液。a、需用托盘天平(仪器D)称量NaClO固体,需用烧杯(仪器C)来溶解NaClO,需用容量瓶(E装置);图示的A和B不需要,还需玻璃棒和胶头滴管,故a错误;b、 配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故b错误;c、配制过程中未用蒸馏水洗涤烧杯和玻璃棒会导致部分溶质没有进入容量瓶,所配的的溶液浓度偏低,故c正确。故选ab。
(4)98%的浓硫酸c(浓)= ![]() =18.4mol/L,将浓硫酸稀释,得稀硫酸,配制过程中H2SO4的物质的量相同,假设需要浓硫酸VmL,则有C浓×V浓= C稀×V稀,即18.4mol/L×V = 2 000 mL ×2.3 mol·L-1 ,所以V=250mL。
=18.4mol/L,将浓硫酸稀释,得稀硫酸,配制过程中H2SO4的物质的量相同,假设需要浓硫酸VmL,则有C浓×V浓= C稀×V稀,即18.4mol/L×V = 2 000 mL ×2.3 mol·L-1 ,所以V=250mL。


科目:高中化学 来源: 题型:
【题目】当反应 COCl2(g)![]() CO(g)+Cl2(g) ΔH>0达到平衡时,分别只再采取下列措施:①升温;②恒容通入惰性气体;③增加CO浓度;④减压;⑤加催化剂;⑥恒压通入惰性气体。其中,能提高COCl2转化率的措施是( )
CO(g)+Cl2(g) ΔH>0达到平衡时,分别只再采取下列措施:①升温;②恒容通入惰性气体;③增加CO浓度;④减压;⑤加催化剂;⑥恒压通入惰性气体。其中,能提高COCl2转化率的措施是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①已知:Cl元素在元素周期表中的位置可以描述为:第3行第17列,请用相同的形式描述Cr元素在元素周期表中的位置______________________。
②COCl2分子中所有原子均满足8电子构型,中心原子的杂化方式为________。COCl2分子中Cl—C—Cl之间的夹角______Cl—C—O之间的夹角(填“>”、“<”或“=”)。
(3)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
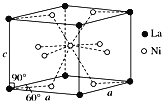
①该晶体的化学式为________________。
②已知该物质的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________nm3(用含M、d、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是__________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阳极区与生成的氯气反应产生少量NCl3,该反应的化学方程式为_____________。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
反应序号 | n (CO2)/mol | V (NaOH) /L | 放出的热量/kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
该条件CO2与NaOH 溶液反应生成NaHCO3的热化学反应方程式为______________________。
(3)利用CO可以将NO转化为无害的N2,其反应为: 2NO(g) +2CO(g) ![]() N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
N甲(CO)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
N乙(CO)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
/p>
①甲容器中,0~40min 内用NO的浓度变化表示的反应速率v(NO)=_____________。
②该反应的△H____0(填“>”或“<”)。
③甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______(填“正向”、“逆向”或“不”)移动。
(4)常温下, 在(NH4)2C2O4溶液中,反应NH4++C2O42-+H2O![]() NH3·H2O+HC2O4-的平衡常数K=________________________。(已知常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离平衡常数Ka1=5×10-2,Ka2=5×10-5)
NH3·H2O+HC2O4-的平衡常数K=________________________。(已知常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离平衡常数Ka1=5×10-2,Ka2=5×10-5)
(5)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理如下图所示
①太阳能电池的负极是__________(填“a”或“b”)
②生成丙烯的电极反应式是_____________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入(或通入)Y溶液中,其生成沉淀的量与加入X的物质的量的关系如下图所示,符合图示情况的是( )
| A | B | C | D |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有Na+、Ca2+、NO、CO![]() 、SO
、SO![]() 、Cl-等离子。为了鉴别这些离子,分别取少量溶液进行以下实验:
、Cl-等离子。为了鉴别这些离子,分别取少量溶液进行以下实验:
①加稀盐酸后,生成无色无味的气体,该气体能使澄清石灰水变浑浊。
②加足量的BaCl2产生白色沉淀,过滤,在沉淀中加入足量的盐酸,沉淀不能完全溶解。
③取②中滤液,加硝酸酸化后,再加过量的AgNO3溶液,析出白色沉淀。
(1)上述3个实验证明一定存在的离子是__________,一定不存在的离子是________,可能存在的离子为_______________。
(2)写出①中涉及反应的离子反应方程式: _____________________________。
(3)实验室中常用于检验Na+是否存在的方法叫___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 滴入酚酞呈无色的溶液中:K+、Al3+、Cl-、CO32-
B. 澄清的溶液中:Na+、K+、MnO4—、AlO2—
C. ![]() =10-13mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3-
=10-13mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3-
D. c(I-)=0.1 mol·L-1的溶液中:Na+、H+、ClO-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com