
【题目】科学家寻找高效催化剂,通过如下反应实现大气污染物转化:
(1)NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应4NH3(g)+5O2(g) ![]() 4NO(g) +6H2O(g) △H<0,测得不同时间的NH3和O2的浓度如下表:
4NO(g) +6H2O(g) △H<0,测得不同时间的NH3和O2的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0. 0072 | 0.0072 |
c(O2)/mol·L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
①前10分钟内的平均速率v(NO)=___________________mol·L-1·min-1
②下列有关叙述中正确的是______________
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内气体的密度不变时,说明反应已达平衡
D.若该反应的平衡常数K值变大,在平衡移动过程中正反应速率先增大后减小
(2)氨催化氧化时会发生下述两个竞争反应I、II。催化剂常具有较强的选择性,即专一性。
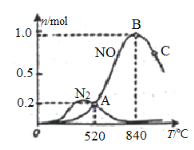
已知:反应I 4NH3(g)+5O2(g) ![]() 4NO(g) +6H2O(g) △H<0
4NO(g) +6H2O(g) △H<0
反应 II:4NH3(g)+3O2(g) ![]() 2N2(g) +6H2O(g) △H<0
2N2(g) +6H2O(g) △H<0
为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3
①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
②反应I的活化能Ea(正)________ Ea(逆) (填“小于”“等于”或“大于”)。
③520℃时,4NH3(g)+5O2![]() 4NO(g)+6H2O(g)的平衡常数K=________________ (不要求得出计算结果,只需列出数字计算式)。
4NO(g)+6H2O(g)的平衡常数K=________________ (不要求得出计算结果,只需列出数字计算式)。
④C点比B点所产生的NO的物质的量少的主要原因_________________________。
(3)羟胺(NH2OH)的电子式_____________,羟胺是一种还原剂,可用作显像剂还原溴化银生成银单质和氮气,该反应的化学方程式为________________________________________。现用25.00mL0.049mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.50mL 0.020mol/L的KMnO4酸性溶液完全作用,则在上述反应中,羟胺的氧化产物是________________________。
【答案】0.088 A Ⅰ 小于 0.24×0.96/(0.44×1.455) 温度升高,催化剂的活性减弱,相同时间生成的NO减少(该反应为放热反应,当温度升高,平衡向左(逆反应)移动) ![]() 2NH2OH+2AgBr==N2↑+2Ag↓+2HBr+2H2O N2O
2NH2OH+2AgBr==N2↑+2Ag↓+2HBr+2H2O N2O
【解析】
(1)①可以计算出氨气或氧气的速率,根据速率比等于化学计量数之比,算出NO的速率;
②A.催化剂可以同等程度的降低正逆反应的活化能,加快其反应速率,故A正确;
B.正逆反应速率比不等于化学计量数之比,未达平衡,故B错误;
C.T、V、m(总)一定,密度一定,不能作为判断是否平衡的依据,故C错误;
D.因为正反应放热反应,若该反应的平衡常数K值变大,说明在降温,平衡移动过程中正反应速率减小,故D错误;
(2)①由图可知,该催化剂在高温时,生成的NO物质的量远大于氮气的,故该催化剂在高温下选择反应I;
②根据△H判断;
③在 1L 密闭容器中充入 1mol NH3和 2mol O2,520℃平衡时n(NO)=n(N2)=0.2mol,则:
4NH3(g)+5O24NO(g)+6H2O(g)
变化(mol ): 0.20.25 0.20.3
4NH3(g)+3O2(g)2N2(g)+6H2O(g)
变化(mol ):0.40.30.20.6
故平衡时,n(NH3)=1mol-0.2mol-0.4mol=0.4mol,n(O2)=2mol-0.25mol-
0.3mol=1.45mol,n(H2O)=0.3mol+0.6mol=0.9mol,由于容器体积为1L,利用物质的量代替浓度计算平衡常数;
④该反应为放热反应,当温度升高,平衡向左(逆反应)移动;
(3) 根据稳定结构书写羟胺(NH2OH)的电子式;反应物羟胺和溴化银,产物银单质和氮气,书写化学方程式;关系式法计算;
(1)①v(NH3)=(1.00-0.12)/10=0.088 mol·L-1·min-1, 根据速率比等于化学计量数之比,算出NO的速率v(NO)=0.088 mol·L-1·min-1。
正确答案:0.088
②A.催化剂可以同等程度的降低正逆反应的活化能,加快其反应速率,故A正确;
B.正逆反应速率比不等于化学计量数之比,未达平衡,故B错误;
C.T、V、m(总)一定,密度一定,不能作为判断是否平衡的依据,故C错误;
D.因为正反应放热反应,若该反应的平衡常数K值变大,说明在降温,平衡移动过程中正反应速率减小,故D错误;
正确答案:A。
(2)①由图可知,该催化剂在高温时,生成的NO物质的量远大于氮气的,故该催化剂在高温下选择反应I;
正确答案:Ⅰ
②因为△H= Ea(正)- Ea(逆) <0,所以Ea(正) <Ea(逆);
正确答案:<。
③在 1L 密闭容器中充入 1mol NH3和 2mol O2,520℃平衡时n(NO)=n(N2)=0.2mol,则:
4NH3(g)+5O24NO(g)+6H2O(g)
变化(mol ): 0.20.25 0.20.3
4NH3(g)+3O2(g)2N2(g)+6H2O(g)
变化(mol ):0.40.30.20.6
故平衡时,n(NH3)=1mol-0.2mol-0.4mol=0.4mol,n(O2)=2mol-0.25mol-
0.3mol=1.45mol,n(H2O)=0.3mol+0.6mol=0.9mol,n(NO)=0.2mol由于容器体积为1L,利用物质的量代替浓度计算平衡常数K=0.24×0.96/(0.44×1.455);
正确答案:0.24×0.96/(0.44×1.455)。
④该反应为放热反应,当温度升高,平衡向左(逆反应)移动;
正确答案:温度升高,催化剂的活性减弱,相同时间生成的NO减少(该反应为放热反应,当温度升高,平衡向左(逆反应)移动)。
(3) 根据稳定结构书写羟胺(NH2OH)的电子式![]() ;反应物羟胺和溴化银,产物银单质和氮气,书写化学方程式2NH2OH+2AgBr==N2↑+2Ag↓+2HBr+2H2O;羟胺失去的电子数等于高锰酸钾得到的电子数,设羟胺氧化产物的化合价为+x,列等式5×24.50mL ×0.020mol/L=(x+1)×25.00mL×0.049mol/L,得x=1,故氧化产物为N2O;
;反应物羟胺和溴化银,产物银单质和氮气,书写化学方程式2NH2OH+2AgBr==N2↑+2Ag↓+2HBr+2H2O;羟胺失去的电子数等于高锰酸钾得到的电子数,设羟胺氧化产物的化合价为+x,列等式5×24.50mL ×0.020mol/L=(x+1)×25.00mL×0.049mol/L,得x=1,故氧化产物为N2O;
正确答案:![]() 2NH2OH+2AgBr==N2↑+2Ag↓+2HBr+2H2O N2O
2NH2OH+2AgBr==N2↑+2Ag↓+2HBr+2H2O N2O


科目:高中化学 来源: 题型:
【题目】在一定条件下,向恒容密闭容器中充入1molN2与4molH2,发生化学反应N2(g)+3H2(g)![]() 2NH3(g),当反应达到最大限度时,下列说法正确的是( )
2NH3(g),当反应达到最大限度时,下列说法正确的是( )
A.V(N2)=V(NH3)
B.单位时间内,断裂1molN![]() N,同时断裂2molN-H
N,同时断裂2molN-H
C.此时,容器内气体的平均摩尔质量不再变化
D.此时,该反应不一定达到了化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为探究铁和浓硫酸反应的产物及性质,用如图所示装置进行实验![]() 夹持装置和A中加热装置已略,气密性已检验
夹持装置和A中加热装置已略,气密性已检验![]()
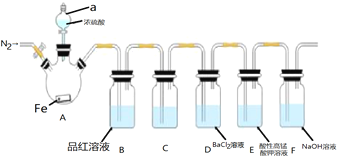
实验开始前,先打开弹簧夹通一段时间N2,关闭弹簧夹后,在A中滴加一定量的浓硫酸,观察实验现象,然后加热,观察到A中有白雾生成,铁片上有气泡产生。已知A中白雾是硫酸与水形成的酸雾。请回答下列问题:
(1)仪器a的名称是___;
(2)加热一段时间后发现B装置中溶液褪色,取出A中的溶液少许,加入KSCN溶液未出现血红色,写出此时A中反应的化学方程式:___;
(3)C装置的作用是除去二氧化硫气体中硫酸蒸汽,则盛放的溶液是___;
A.水 B.NaOH溶液 C.饱和Na2SO3溶液 D.饱和NaHSO3溶液
(4)实验开始前,先通一段时间N2的目的是___;
(5)可以证明H2SO3是弱酸的实验装置是___;
(6)E中的现象是___,该现象表明SO2具有___性;
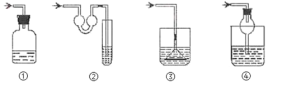
(7)装置F的作用是吸收尾气,写出该装置中反应的化学方程式___,以下各种尾气吸收装置中,适合于吸收该尾气,而且能防止倒吸的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等体积的0.1 mol/L AgNO3溶液和0.1 mol/L NaCl溶液混合得到浊液,过滤后进行如下实验:
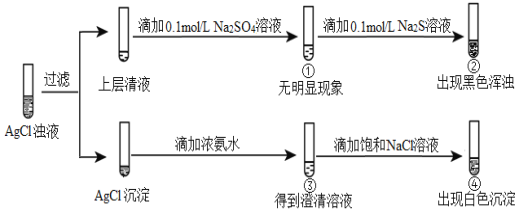
下列分析不正确的是
A. ①的现象说明上层清液中不含Ag+
B. ②的现象说明该温度下Ag2S比Ag2SO4更难溶
C. ③中生成Ag(NH3)2+,促进AgCl(s)溶解平衡正向移动
D. 若向③中滴加一定量的硝酸,也可以出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)![]() 3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是
3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是
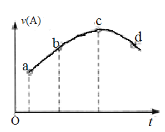
A. 反应物A的浓度:a点小于b点
B. A的平均反应速率:ab段大于bc段
C. 曲线上的c、d两点都表示达到平衡状态
D. 该反应的生成物可能对反应起催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
编号 | 实验装置 | 实验现象 |
1 |
| 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 |
2 |
| 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 |
3 |
| 铜棒表面的现象是______________________,电流计指针___________________ |
①通过实验2和3,可得出原电池的形成条件是______________________________。
②通过实验1和3,可得出原电池的形成条件是______________________________。
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是___________________。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________________________。
Cu棒:______________________________。
(3)实验3的电流是从________棒流出(填“Zn”或“Cu”),反应过程中若有0.4mol电子发生了转移,则Zn电极质量减轻___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是
A. PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B. 绿色化学要求从源头上消除或减少生产活动对环境的污染
C. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D. 天然气和液化石油气是我国目前推广使用的清洁燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池的工作原理如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
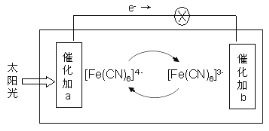
A.K+移向催化剂b
B.催化剂a表面发生的化学反应:[Fe(CN)6]4- - e- = [Fe(CN)6]3-
C.[Fe(CN)6]3-在催化剂b表面被氧化
D.电解质溶液中的[Fe(CN6)]4-和[Fe(CN6)]3-浓度基本保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】模拟工业上离子交换膜法制烧碱的方法,电解硫酸钾溶液可制备氢气、氧气、硫酸和氢氧化钾,装置如图所示。下列说法不正确的是( )
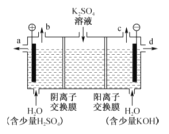
A. 通电开始后,阴极附近溶液pH增大
B. 制得的氢氧化钾溶液从出口d流出
C. 电解槽的阳极反应式为2H2O﹣4e-=4H++O2↑
D. 通过阴离子交换膜的离子数等于通过阳离子交换膜的离子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com