

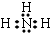 .
.
分析 (1)由图可知反应①生成物的总能量比反应物的总能量高,故为吸热反应;根据盖斯定律来计算反应的焓变并书写热化学方程式;
(2)①N元素二周期第ⅤA族,氨气中氮原子与氢原子形成三对共用电子对;
②根据温度和压强对化学平衡移动的影响知识来回答;
(3)改变一个条件,再次达到新平衡时,平衡常数K值变大,说明改变反应温度使正向移动,NH3的反应为放热反应,故应为降温;
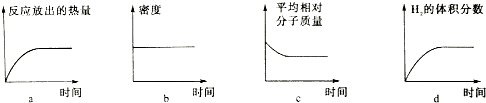
(4)①400℃,28MPa时,将1molN2和3mol H2混合充入体积可变的密闭容器中,反应放热,随反应的进行,放出的热量增大,混合气体质量不变,容器体积减小,混合气体密度增大,反应正向进行,混合气体质量不变,总物质的量减少,混合气体的平均相对分子质量增大,氢气的体积分数减小,也不会从0开始,据此分析;
②400℃,28MPa时,将1molN2和3mol H2混合充入体积可变的密闭容器中,加入催化剂,10分钟后反应达到平衡平衡时N2转化率为60%,列三段式计算平衡时各物质的物质的量和压强,代入K计算;
(5)设反应起始各去1mol,反应氮气x,列三段式,根据氢气的体积分数计算x的值,再由气体的压强之比等于气体的物质的量之比计算.
解答 解:(1)由图可知反应①生成物的总能量比反应物的总能量高,故为吸热反应;由图示可得:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+76.9kJ/mol;CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ/mol.由盖斯定律得CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+118.1kJ/mol;
故答案为:吸热;CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+118.1kJ/mol;
(2)①N元素二周期第ⅤA族,氨气的电子式为: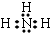 ;
;
故答案为:第二周期第ⅤA族;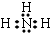 ;
;
②欲使溶液再生,即使平衡向左移动,所以应高温、低压;
故答案为:b;
(3)改变一个条件,再次达到新平衡时,平衡常数K值变大,说明改变反应温度使正向移动,NH3的反应为放热反应,故应为降温,则逆反应速率先减小再增大;
故答案为:AD;
(4)①400℃,28MPa时,将1molN2和3mol H2混合充入体积可变的密闭容器中,反应放热,随反应的进行,放出的热量增大,a正确;混合气体质量不变,容器体积减小,混合气体密度增大,b错误;反应正向进行,混合气体质量不变,总物质的量减少,混合气体的平均相对分子质量增大,c错误;氢气的体积分数减小,也不会从0开始,d错误;
故答案为:a;
②400℃,28MPa时,将1molN2和3mol H2混合充入体积可变的密闭容器中,加入催化剂,10分钟后反应达到平衡平衡时N2转化率为60%,列三段式;
N2(g)+3H2(g)?2NH3(g)
n始:1 3 0
n转:0.6 1.8 1.2
n平:0.4 1.2 1,2
则P(N2)=$\frac{0.4}{2.8}$×28MPa=4MPa,P(H2)=$\frac{1.2}{2.8}$×28MPa=12MPa=P(NH3),化学平衡常数Kp=$\frac{{P}^{2}(N{H}_{3})}{{P}^{\;}({N}_{2})•{P}^{3}({H}_{2})}$=$\frac{1{2}^{2}}{4×1{2}^{3}}$≈0.021(MPa)-2;
故答案为:0.021(MPa)-2;
(5)设反应起始各1mol,反应氮气x,列三段式,
N2(g)+3H2(g)?2NH3(g)
n始:1 1 0
n转:x 3x 2x
n平:1-x 1-3x 2x
H2的体积分数为30%,则$\frac{1-3x}{1-x+1-3x+2x}$=0.3,解得x=$\frac{1}{6}$,气体的压强之比等于气体的物质的量之比,则容器内的压强与起始压强之比为(1-$\frac{1}{6}$+1-3×$\frac{1}{6}$+2×$\frac{1}{6}$):2=5:6;
故答案为:5:6.
点评 本题考查了盖斯定律、分子电子式、影响化学平衡的因素及化学平衡的有关技术,读懂信息,灵活运用所学知识是关键,题目难度较大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高体系的温度或增加某一组分的浓度均能增加反应体系中活化分子所占百分数 | |
| B. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl反应中化学能只转变为热能 | |
| C. | 面粉生产工厂要求严禁烟火是因为面粉有机物颗粒极小,总表面积巨大容易被引燃爆炸 | |
| D. | 高锰酸钾受热分解是一个熵减小的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如改变体系温度,体系颜色一定发生变化 | |
| B. | 如仅仅改变浓度这一条件,使得体系颜色加深,则上述平衡一定正移 | |
| C. | 继续充入HI气体,则HI的转化率将减小 | |
| D. | 温度不变时,当体系颜色变浅,则正反应速率和逆反应速率都将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  图可表示对平衡N2(g)+3H2(g)?2NH3(g)加压、同时移除部分NH3时的速率变化 | |
| B. |  图中a、b曲线只可表示反应H2(g)十I2(g)?2HI(g)在有催化剂和无催化剂存在下建立平衡的过程 | |
| C. | 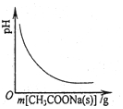 图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化 | |
| D. | 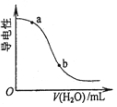 图表示向醋酸溶液中加水时其导电性变化,则CH3COOH溶液的pH:a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金的硬度一般比各组分金属的低 | B. | 合金中可能含有非金属元素 | ||
| C. | 合金中肯定含有金属元素 | D. | 合金的熔点一般比各组分金属的低 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| c值范围 | 被氧化的离子符号 | 被氧化离子的物质的量/mol |
| 0<c≤a | ① | ② |
| a<c≤$\frac{3a+b}{2}$ | ③ | ④ |
| $\frac{3a+b}{2}$<c≤3$\frac{a+b}{2}$ | ⑤ | ⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com