
| 选项 | A | B | C | D |
| 剩余固体 | Cu(NO3)2、CuO | Cu2O、CuO | Cu2O、CuO | Cu(NO3)2、Cu2O |
| 剩余气体 | 无气体剩余 | 氧气2.5×10-3mol | NO 2.5×10-3mol | 氧气2.5×10-3mol |
| A. | A | B. | B | C. | C | D. | D |
分析 3.76g硝酸铜的物质的量为$\frac{3.76g}{188g/mol}$=0.02mol,强热一段时间后得到1.52g固体和NO2、O2的混合气体,假设硝酸铜恰好分解得到CuO、NO2、O2,根据Cu元素守恒,则剩余固体质量为0.02mol×80g/mol=1.6g>1.52g,假设硝酸铜恰好分解得到Cu2O、NO2、O2,根据Cu元素守恒,则剩余固体质量为0.02mol×$\frac{1}{2}$×144g/mol=1.44g<1.52g,故最终剩余固体为CuO、Cu2O的混合物,设CuO为xmol,Cu2O为ymol,根据Cu元素守恒及二者总质量列方程计算各自物质的量,根据氮元素守恒计算NO2物质的量,进而计算O2的物质的量,混合物通过水时,发生反应:4NO2+O2+2H2O=4HNO3,若NO2过量,过量的NO2与水发生反应:3NO2+H2O=2HNO3+NO,结合方程式计算判断剩余气体组成及物质的量.
解答 解:3.76g硝酸铜的物质的量为$\frac{3.76g}{188g/mol}$=0.02mol,强热一段时间后得到1.52g固体和NO2、O2的混合气体,假设硝酸铜恰好分解得到CuO、NO2、O2,根据Cu元素守恒,则剩余固体质量为0.02mol×80g/mol=1.6g>1.52g,假设硝酸铜恰好分解得到Cu2O、NO2、O2,根据Cu元素守恒,则剩余固体质量为0.02mol×$\frac{1}{2}$×144g/mol=1.44g<1.52g,故最终剩余固体为CuO、Cu2O的混合物,
设CuO为xmol,Cu2O为ymol,根据Cu元素守恒及二者总质量,则:
x+2y=0.02
80x+144y=1.52
联立方程解得:x=0.01,y=0.005
混合气体总质量为3.76g-1.52g=2.24g,根据氮元素守恒可知,NO2的物质的量为0.04mol,则氧气质量为2.24g-0.04mol×46g/mol=0.4g,氧气物质的量为$\frac{0.4g}{32g/mol}$=0.0125mol,
由4NO2+O2+2H2O=4HNO3,可知氧气完全反应需要二氧化氮为0.0125mol×4=0.05mol,大于0.04mol,故氧气有剩余,则参加反应的氧气为0.04mol×$\frac{1}{4}$=0.01mol,故剩余氧气为0.0125mol-0.01mol=0.0025mol=2.5×10-3mol,
故选B.
点评 本题考查混合物计算,关键是利用假设法确定残留固体的成分,是对学生综合能力的考查,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 4mol | B. | 5mol | C. | 6mol | D. | 7mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键是一种较弱的化学键 | |
| B. | NH3的稳定性很强,是因为其分子间能形成氢键 | |
| C. | 常温下,Cl2、Br2、I2的状态从气态、液态到固态,主要原因是分子间作用力在逐渐增大 | |
| D. | 最外层能达到稳定结构的微粒只是稀有气体的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
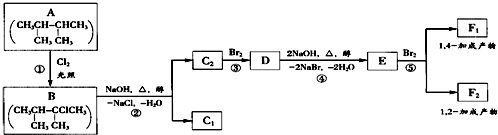
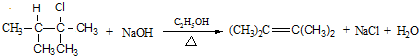 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
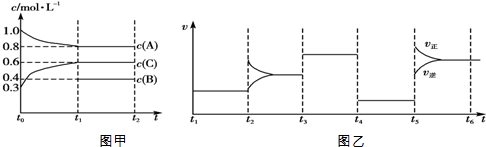
| A. | 该反应为吸热反应 | |
| B. | B在t0~t1阶段平衡时转化率为60% | |
| C. | t4~t5阶段改变的条件为减小压强 | |
| D. | 此温度下该反应的化学平衡常数K=$\frac{27}{32}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正戊烷<异戊烷<新戊烷 | B. | 正戊烷>新戊烷>异戊烷 | ||
| C. | 邻二甲苯>间二甲苯>对二甲苯 | D. | 邻二甲苯<间二甲苯<对二甲苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com