
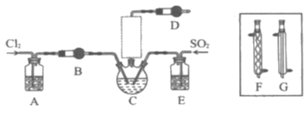
【题目】随着5G时代的到来,半导体材料将迎来快速发展,三氯化氧磷(POCl3)常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室利用PCl3、SO2、Cl2在60~65°C时反应制备POCl3和SOCl3的实验装置如图所示(气体的制备装置未画出)。
资料卡片:
物质 | 熔点/°C | 沸点/°C | 其他 |
PCl3 | -93.6 | 76.1 | 遇水剧烈水解,易与O2反应 |
POCl3 | 1.25 | 105.8 | 遇水剧烈水解,能溶于PCl3 |
SOCl3 | -105 | 78.8 | 遇水剧烈水解,受热易分解 |
(1)该反应的化学方程式为___。
(2)A、B装置中的试剂分别是___、___。
(3)装置E的作用是___。
(4)反应装置的虚线框中未画出的仪器最好选用___(填“F”或“G”),理由是___。
(5)反应结束后,提纯POCl3的操作是___(填操作名称)。
(6)测定某掺杂剂中POCl3的含量(杂质不参与反应):准确称取4.000g样品在水解瓶中摇动至完全水解,将水解液配成250mL溶液,取25.00mL于锥形瓶中,加入0.4000molL-1的AgNO3溶液25.00mL,再加少许硝基苯,用力振荡。加入NH4Fe(SO4)2作指示剂,用0.l000molL-1KSCN标准溶液滴定过量的AgNO3至终点,消耗KSCN标准溶液22.00mL。[已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12,Ag3PO4可溶于硝酸,POCl3的相对分子质量为153.5]
①加入少量的硝基苯的目的是___。
②POCl3的质量分数为___。(保留一位小数)
【答案】PCl3+SO2+Cl2![]() POCl3+SOCl2 饱和食盐水 P2O5或无水CaCl2 干燥SO2,通过观察产生气泡的速率控制通入气体的流速 F 球形冷凝管接触面积大,便于反应中各物质冷凝回流 蒸馏 覆盖在AgCl表面,避免AgCl转化为AgSCN 99.8%
POCl3+SOCl2 饱和食盐水 P2O5或无水CaCl2 干燥SO2,通过观察产生气泡的速率控制通入气体的流速 F 球形冷凝管接触面积大,便于反应中各物质冷凝回流 蒸馏 覆盖在AgCl表面,避免AgCl转化为AgSCN 99.8%
【解析】
本题考查PCl3、SO2、Cl2在60~65°C时反应制备POCl3和SOCl3的实验,根据资料卡片,本实验必须在无水条件下反应,所以装置A用饱和食盐水除去氯气中的氯化氢,B用P2O5或无水CaCl2除去氯气中的水蒸气,E用浓硫酸除去二氧化硫中的水蒸气,且A和E都可以通过观察产生气泡的速率控制通入气体的流速,D用无水CaCl2防止空气中的水蒸气进入,用F球形冷凝管进行冷凝回流,将PCl3充分反应,提高产率。
(1)该反应在60~65°C时反应,化学方程式为:PCl3+SO2+Cl2![]() POCl3+SOCl2;
POCl3+SOCl2;
(2)A装置用饱和食盐水除去氯气中的氯化氢,B装置用P2O5或无水CaCl2除去氯气中的水蒸气,所以A、B装置中的试剂分别是饱和食盐水、P2O5或无水CaCl2;
(3)装置E用浓硫酸除去二氧化硫中的水蒸气,且控制产生气泡的速率控制反应速率,所以E的作用是干燥SO2,通过观察产生气泡的速率控制通入气体的流速;
(4)球形冷凝管与直球形冷凝管最大区别是球形冷凝管接触面积大,冷凝效果更好,能将反应物和生成物都充分冷凝回流,增加产率,所以虚线框中用球形冷凝管F,因为球形冷凝管接触面积大,便于反应中各物质冷凝回流;
(5)根据资料卡片POCl3和SOCl2的沸点不同,所以提纯POCl3的操作是蒸馏;
(6)①根据Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12,AgSCN溶解度更小,所以用KSCN标准溶液滴定过量的AgNO3时,要避免AgCl转化为AgSCN,影响测定,故加入少量的硝基苯的目的是覆盖在AgCl表面,避免AgCl转化为AgSCN ;
②根据条件可知:AgNO3的总物质的量为:0.4mol/L×0.025L=0.01mol, KSCN的物质的量为0.1mol/L×0.022L=0.0022mol,SCN-反应的Ag+为0.0022mol,Cl-反应的Ag+为0.01mol- 0.0022mol=0.0078 mol,Cl-的物质的量是0.0078 mol,根据元素守恒则25ml中POCl3物质的量是0.0078 mol×![]() =0.0026 mol,则4.000g样品中POCl3物质的量是0.0026 mol×10=0.026 mol,POCl3的质量分数为
=0.0026 mol,则4.000g样品中POCl3物质的量是0.0026 mol×10=0.026 mol,POCl3的质量分数为![]() =99.8%。
=99.8%。


科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A.溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
C.反应:CO+NO2![]() CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度,平衡向逆反应方向移动
D.对2H2O2![]() 2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率
2H2O+O2↑的反应,使用MnO2可加快制O2的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属之一。也是中学中常见的过镀金属元素。铜是与人类关系非常密切的有色金属。被广泛地作力导线应用于电气、轻工、机械制造、建筑工业、国防工业等领域在中国有色金属材料的消费中仅次于铝。回答下列问题:
(1)基态Cu+原子核外电子排式为___。
(2)CuCl晶体的晶格能可通过如图的Born-Haber循环计算得到:
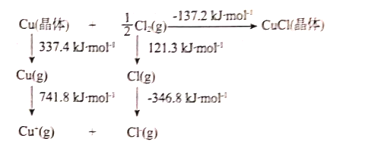
铜原子的第一电离能为___kJmol-1;Cl-Cl键键能为___kJmol-1;CuCl的晶格能为___kJmol-1。
(3)铜盐属于重金属盐,铜盐中毒可用青霉胺解毒,解毒原理如下:Cu2+能与青霉胺成环状络合物,该环状络合物无毒、易溶于水,可经尿液排出。

①青霉胺分子中S原子的轨道杂化类型为___;
②硫化氢与氨气键角的大小:H2S___NH3(填“>”或“<”)。
③第二周期元素中,第一电离能大于N的元素有___(用元素符号表示)。
④该环状络合物无毒、易溶于水,可经尿液排出,请解释该化合物易溶于水的主要原因:___。
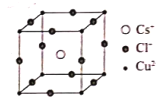
(4)某含铜的离子化合物M由Cs、Cu、Cl三种元素构成,M属于立方体晶系的离子晶体,其结构如图所示。试回答下列问题:
①离子化合物M的化学式为___;
②已知Cs和Cl两元素离子的半径大小相近,该晶体中两种离子联合组成何种形式的密堆积___;
③若晶胞参数为anm,则这种晶体密度为___gcm-3(用含a、和NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下:
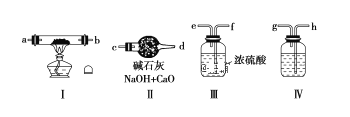
请回答下列问题:
(1)若规定气体的流动方向为从左到右,则组合实验装置时各仪器的连接顺序是:
空气→Ⅳ→____→___→____(填“Ⅰ、Ⅱ、Ⅲ”,仪器不能重复使用)。
(2)装置Ⅳ中盛放的药品是____,其作用是_______。
(3)装置Ⅱ的作用是______。
(4)操作中通空气和加热的先后顺序为________。
(5)若去掉装置Ⅲ,装置Ⅰ中除反应生成Na2O2外,还可能发生的反应有______(写出两个化学方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.00mol·L-1盐酸滴入20.00mL1.00mol·L-1的氨水中,溶液pH和温度随加入盐酸体积的变化曲线如图所示。
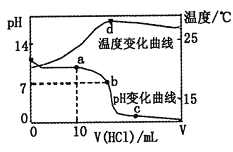
下列有关说法中不正确的是( )
A. a点溶液中离子浓度大小关系:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B. b点溶液中离子浓度大小关系:c(NH4+)=c(Cl-)>c(H+)=c(OH-)
C. c点溶液中离子浓度大小关系:c(NH4+)+c(H+)=c(Cl-)+c(OH-)
D. d点时溶液温度达到最高,之后温度略有下降,原因是NH3·H2O电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下物质:①石墨;②氯化氢气体;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;⑦氯化铁溶液;⑧纯醋酸;⑨氧化钠固体;⑩铝。
(1)属于非电解质的是______________;属于强电解质的是__________;属于弱电解质的是___________。(用序号填空)
(2)写出物质⑥溶于水溶液显碱性的原因_______(用离子方程式和简要文字说明作答)
(3)写出物质⑥和⑧在水中反应的离子方程式:_____________。
(4)配制溶液⑦时通常将⑦先溶于___________,然后再加水稀释,通过增加溶液中_______的浓度以防止其发生水解。
(5)浓度、体积相同的②和⑧的溶液,加入相同形状且足量的Zn粒,反应速率快的是___(用序号填空);pH值、体积相同的②和⑧的溶液时,产生气体的量多的是________。(用序号填空)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)的结构如图![]() ,具有强还原性的二元弱酸,可以被银离子氧化为磷酸。
,具有强还原性的二元弱酸,可以被银离子氧化为磷酸。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的方程式___;
(2)Na2HPO3是________(填“正盐”或“酸式盐”);
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________;
(4)某温度下,0.10molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2molL-1,该温度下H3PO3的一级电离平衡常数Ka1=______;(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”);
(6)向某浓度的亚磷酸中滴加NaOH溶液,其pH与溶液中的H3PO3、H2PO3—、HPO32—的物质的量分数a(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。
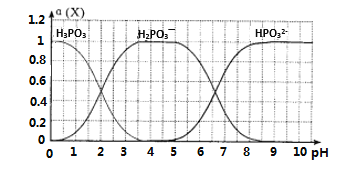
以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和另一种“反应物”在40~50 ℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧,跟盐酸反应能产生气体。下列有关推断中错误的是()
A.这里的"另一种反应物"具有还原性B.CuH可作氧化剂、还原剂
C.CuH+Cl2![]() CuCl+HCl(燃烧)D.CuH+HCl
CuCl+HCl(燃烧)D.CuH+HCl![]() CuCl+H2↑(常温)
CuCl+H2↑(常温)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃下,某反应达到平衡,平衡常数K=![]() 。恒容时,温度升高时NO浓度减小。下列 说法正确的是
。恒容时,温度升高时NO浓度减小。下列 说法正确的是
A.该反应的焓变为正值
B.若恒温下增大压强(缩小体积),则反应体系的颜色加深
C.在t℃时,加入催化剂,该反应的化学平衡常数增大
D.该反应化学方程式为NO+SO3![]() NO2+SO2
NO2+SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com