
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A、反应在前50 s的平均速率为v(PCl3)=0.0032 mol?L-1?s-1 |
| B、T℃时,该反应的平衡常数为0.025 |
| C、保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol?L-1,则反应的△H<0 |
| D、相同温度下,向容器中再充入1.0 mol PCl5,达到平衡时,PCl5的转化率大于20% |
| ||
| △t |
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
| ||
| 50s |
| 0.1×0.1 |
| 0.4 |
| 0.1mol/L |
| 0.5mol/L |


科目:高中化学 来源: 题型:
| A、向稀硫酸中加入氢氧化钡溶液 H++SO42-+Ba2++HO-=H2O+BaSO4↓ |
| B、向石灰水中加入硝酸溶液 H++OH-=H2O |
| C、向氧化镁中加入硫酸溶液 Mg2++SO42-=MgSO4 |
| D、向硝酸银溶液中加入锌粉 Zn+Ag+=Zn2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:
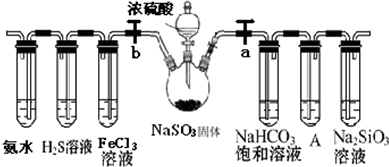
查看答案和解析>>
科目:高中化学 来源: 题型:
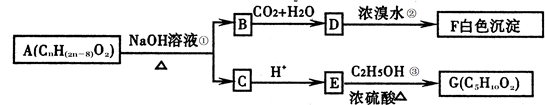
查看答案和解析>>
科目:高中化学 来源: 题型:
 ):又当苯环上连卤原子时,高温高压下可以水解.
):又当苯环上连卤原子时,高温高压下可以水解.| NaCN |
| 醇溶液 |
| H2O |
| H2SO4 |



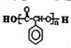 的合成路线流程图(无机试剂任选,限用4步完成).合成路线流程图如图:
的合成路线流程图(无机试剂任选,限用4步完成).合成路线流程图如图: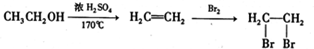
查看答案和解析>>
科目:高中化学 来源: 题型:
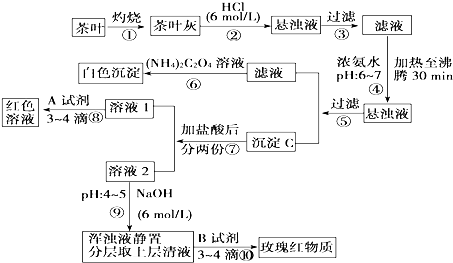
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.6molSO2+0.3molO2+0.4molSO3 |
| B、4.0molSO2+1.0molO2 |
| C、2.0molSO2+1.0molO2+2.0molSO3 |
| D、3.0molSO2+1.0molO2+1.0molSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
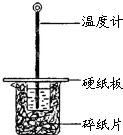 某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法不正确的是( )
某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.下列说法不正确的是( )| A、该实验也可在保温杯中进行 |
| B、图中实验装置缺少环形玻璃搅拌棒 |
| C、烧杯间填满碎纸条的作用是保温、隔热,减少热量损失 |
| D、若将盐酸体积改为60 mL,两次实验所求得中和热不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H5OH在电池的负极上发生氧化反应 |
| B、1mol乙醇被氧化转移6 mol电子 |
| C、在外电路中电子由负极沿导线流向正极 |
| D、电池正极的电极反应为4H++O2+4e-═2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com