
| A、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物.高空中的飘尘在大气中可形成胶体 |
| B、自来水厂用明矾KAl(SO4)2?12H2O对天然水进行消毒、杀菌,可使硬水变软水 |
| C、自行车钢架生锈主要是电化学腐蚀所致 |
| D、洪涝、地震灾区灾后可用熟石灰消毒,是利用熟石灰可使蛋白质发生变质的性质 |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| A、①②③④全正确 |
| B、只有①②③正确 |
| C、只有①③正确 |
| D、只有①③④正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| B、食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 |
| C、人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 |
| D、针对病毒性流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、酒精、双氧水等适宜的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 18mol?L-1浓硫酸与足量铜反应,转移电子数为1.8NA |
| B、0.5L 0.2mol?L-1氯化铁溶液中Fe3+数目为0.1NA |
| C、0.4mol SiO2晶体中所含的共价键数目为1.6NA |
| D、已知t℃时,MgCO3的K=4.0×10-6,则MgCO3饱和溶液中含Mg2+数目为2×10-3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
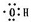 ;
;| A、①②⑤ | B、①④⑥⑦ |
| C、②③④⑥ | D、②③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,pH小于7 |
| B、存在关系式:c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| C、25℃时,由水电离产生的c(H+)>1×10-7mol?L-1 |
| D、向溶液中加入少量NaOH固体,c(S2-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视.某研究小组利用反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用.
近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视.某研究小组利用反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用.| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com