
| A.9.0 | B.9.5 | C.8.5 | D.10.5 |
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:不详 题型:单选题
| A.AgCl>AgI>Ag2CrO4 | B.AgCl> Ag2CrO4>AgI |
| C.Ag2CrO4> AgCl> >AgI | D.Ag2CrO4> AgI> AgCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| A.将难溶电解质放入纯水中,溶解达到平衡时,升高温度, Ksp 一定增大 |
| B.两种难溶盐电解质,其中Ksp小的溶解度也一定小 |
| C.难溶盐电解质的Ksp与温度有关 |
| D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
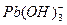 、
、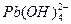 ,各形态的浓度分数α随溶液pH变化的关系如下图所示:
,各形态的浓度分数α随溶液pH变化的关系如下图所示: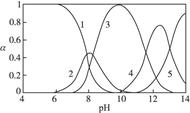
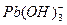 ,5表示
,5表示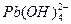
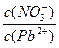 ___________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
___________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后, 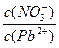 增大,可能的原因是_____________。
增大,可能的原因是_____________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③④ | B.①②③ | C.③④⑤ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
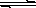 Cu2+(aq)+2OH-(aq),常温下其Ksp=2×10-20则:
Cu2+(aq)+2OH-(aq),常温下其Ksp=2×10-20则: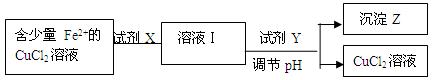
| 金属 离子 | pH | |
| 开始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
 A.H2O2 B.KMnO4 C.HNO3 D.Cl2
A.H2O2 B.KMnO4 C.HNO3 D.Cl2查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.有AgCl沉淀析出  | B.无AgCl沉淀析出 |
| C.有沉淀析出,但不是AgCl | D.无法确定是否有沉淀析出 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.AgBr、AgCl | B.Ag2CrO4、AgCl |
| C.AgBr、Ag2CrO4 | D.同时沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com