
【题目】周辉《清波杂志》卷十二:信州铅山胆水自山下注,势若瀑布,用以浸铜,铸冶是赖,虽干溢系夫旱涝,大抵盛于春夏,微于秋冬。古传一人至水滨,遗匙钥,翌日得之,已成铜矣。这里的胆水是指
A. FeSO4 溶液 B. CuSO4 溶液 C. 氨水 D. NaCl溶液
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】N2H4通常用作火箭的高能燃料,N2O4作氧化剂。请回答下列问题:
(1)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+a kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-b kJ/mol
2NO2(g)N2O4(g) ΔH=-c kJ/mol
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式__________________。
(2) N2、H2合成氨气为放热反应。800 K时向下列起始体积相同的密闭容器中充入2molN2、3molH2,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙是绝热容器,三容器各自建立化学平衡。

①达到平衡时,平衡常数K甲__________K乙__________K丙(填“>”、“<”或“=”)。
②达到平衡时N2的浓度c(N2)甲__________c(N2)乙,c(N2)乙__________c(N2)丙(填“>”、“<”或“=”)。
③对甲、乙、丙三容器的描述,以下说法正确的是__________。
A.乙容器气体密度不再变化时,说明此反应已达到平衡状态
B.在甲中充入稀有气体He,化学反应速率加快
C.向甲容器中充入氨气,正向速率减小,逆向速率增大
D.丙容器温度不再变化时说明已达平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
A.将 SO2 通入水中
B.将 HCl 通入水中
C.烧碱溶于水
D.硫酸氢钾溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度下,有相同体积的甲、乙两容器,甲容器中充入1g N2和1g H2,乙容器中充入2g N2和2g H2。下列叙述中,错误的是
A. 化学反应速率:乙>甲 B. 平衡后N2的浓度:乙>甲
C. H2的转化率:乙>甲 D. 平衡混合气中H2的体积分数:乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】震惊全国的天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏而造成环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理。
资料:氰化钠化学式NaCN(N元素-3价),白色结晶颗粒,剧毒,易溶于水
(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,写出该反应的化学方程式________________。
(2)某化学兴趣小组实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过下图装置制备Na2S2O3。
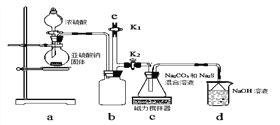
①a装置中盛浓硫酸的仪器名称是_______________;
b装置的作用是________________。
②c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有___________________。
③实验结束后,在e处最好连接盛_________(选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1,目的是__________________
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:
① 废水中氰化钠的最高排放标准为0.50 mg/L。
② Ag++2CN- = [ Ag (CN)2]-, Ag++I- = AgI↓, AgI呈黄色,且CN-优先与Ag+反应。
实验如下:
取25.00 mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000 ×10-4 mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.50 mL。
④滴定终点的判断方法是____________________
⑤处理后的废水中氰化钠的含量为__________mg/L,_______(选填“能”、“不能”)排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为 0.1 mol·L-1 的下列溶液: ①硫酸 ②醋酸 ③氢氧化钠
请回答下列问题:
(1)三种溶液中由水电离出的 H+浓度由大到小的顺序是(填序号)____________。
(2)已知 T ℃, KW=1×10-13,则 T ℃_________25 ℃(填“>”、 “<”或“=”)。在 T ℃时将pH=11的NaOH溶液a L与 pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则 a∶b=____________。
(3) 25 ℃时,有 pH=x 的盐酸和 pH=y 的氢氧化钠溶液(x≤6, y≥8),取 a L 该盐酸与 b L该氢氧化钠溶液反应,恰好完全中和,求:
①若 x+y=14,则 a/b=____________(填数据);
②若 x+y=13,则 a/b=____________(填数据);
③若 x+y>14,则 a/b=____________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的 pH 满足关系____________(用 x、 y 表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.13 mL稀盐酸
B.用托盘天平称量25.20 g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是
A.NaHSO4=Na++H++SO42- B.NaHCO3=Na++H++CO32-
C.CH3COOH=CH3COO-+H+ D.H2CO32H++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固态化合物A不导电,但熔化或溶于水都能完全电离。下列关于物质A的说法中,―定正确的是
A.非电解质 B.弱电解质 C.离子化合物 D.易溶性盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com