
分析 Y的单质晶体熔点高、硬度大,是一种重要的半导体材料可知Y为Si,则X、Y、Z、W都在第三周期,再由X+与M2-具有相同的电子层结构;离子半径:Z2->W-;依次推出X为Na,M为O,Z为S,W为Cl,据此解答各小题即可.
解答 解:依据分析可知:X为钠,Y为硅,Z为硫,W为氯,M为氧,
(1)Y为Si,名称是:硅,故答案为:硅;
(2)W为Cl,Cl有3个电子层,最外层电子数为7,故位于第三周期第ⅦA族,故答案为:三;VIIA;
(3)X2M2 为Na2O2 中存在钠离子与过氧根离子形成的离子键,过氧根中存在O-O非极性共价键,故答案为:离子键、共价键;
(4)元素的非金属性越强,其气态氢化物越稳定,由于非金属性Cl>S,故答案为:HCl>H2S.
点评 本题考查位置、结构、性质的关系和应用,寻找本题的突破点为Y是解答本题的关键,然后利用元素化合物知识来解答即可.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 含有共价键的化合物不可能是离子化合物 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;1124Na.
;1124Na.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
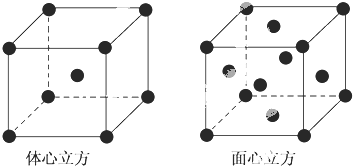
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
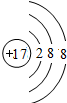 、
、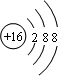 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测定某稀醋酸溶液的pH | |
| B. | 做完银镜反应的试管可以用氨水来洗涤 | |
| C. | 为了除去苯中混有的少量苯酚,加入足量浓溴水,充分搅拌后过滤分离 | |
| D. | 如果苯酚浓溶液沾到皮肤上,应立即用酒精擦洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com