
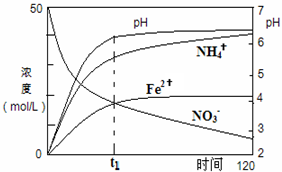
 氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.
氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.| 5.6×10-3L |
| 22.4L/mol |
| 5 |
| 2 |
| 5.6×10-3L |
| 22.4L/mol |
| 0.01mol |
| 0.025L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在混合物中加入盐酸,充分振荡,再用分液漏斗分离 |
| B、在混合物中加入NaOH溶液,充分振荡,再通入过量CO2气体,待完全反应后,用分液漏斗分离 |
| C、将混合物用蒸馏方法分离 |
| D、在混合物中加入乙醚,充分振荡,萃取苯酚,然后再用分液漏斗分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu与稀盐酸 |
| B、NaHCO3与NaOH溶液 |
| C、CaCO3与稀硫酸 |
| D、NH4HCO3与稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
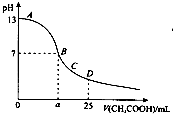 常温下,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是( )
常温下,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图所示,下列有关离子浓度关系的比较,正确的是( )| A、在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、在B点a>12.5,且有:c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| C、在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| D、在D点:c(CH3COO-)+c(CH3COOH)=2 c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com