
Cu与一定浓度的HNO3反应为:3Cu+2NO3—+xH+ 3Cu2++2R+yH2O。
3Cu2++2R+yH2O。
(1)反应中的x= 。
(2)反应产物R的化学式为 。
(3)参加反应的Cu和消耗HNO3的物质的量之比为 。
(4)1.5 mol Cu完全反应时转移的电子数为 。
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:填空题
(15分)2012年4月15日,央视曝光河北一药用胶囊厂用皮革废料所生产明胶作原料。这些企业用生石灰处理皮革废料进行脱色漂白和清洗,随后熬制成工业明胶,卖给浙江新昌县药用胶囊生产企业,最终流向药品企业,进入消费者腹中。记者调查发现9家药厂的13个批次药品所用胶囊重金属铬含量超标。重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下: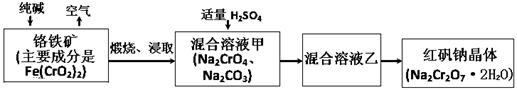
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2为了加快该反应的反应速率,可采取的措施是 。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:2CrO42-+2H+= Cr2O72-+H2O ;
3CrO42-+4H+= Cr3O102-+2H2O ① 往混合溶液甲中加入硫酸必须适量的原因是 。
② 混合溶液乙中溶质的化学式是 。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O  2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:□Cr2O72-+□S2-+□H2O - □Cr(OH)3+□S2O32-+□OH-
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)电解饱和食盐水之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂和操作有a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸,d.过滤,其合理的加入顺序为________(填字母代号)。
(2)电解饱和食盐水时离子交换膜的作用是_____________________________
(3)电解饱和食盐水时,如果在容积为10 L的离子交换膜电解槽中,1 min在阳极可产生11.2 L(标准状况)Cl2,这时溶液的pH是(设体积维持不变)________。
(4)Cl2常用于自来水的杀菌消毒,现有一种新型消毒剂ClO2,若它们在杀菌过程中还原产物均为Cl-,消毒等量的自来水,所需Cl2和ClO2的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:
(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为________>________>________;
(2)当n(Cl2)=0.12 mol时,溶液中的离子主要为________________________________,
从开始通入Cl2到n(Cl2)=0.12 mol时的总反应的化学方程式为______________________;
(3)当溶液中n(Cl-)∶n(IO3-)=8∶1时,通入的Cl2在标准状况下的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+ 6Na2O2=2Na2FeO4+ 2Na2O + 2Na2SO4+ O2↑
①该反应中的氧化剂是________,还原剂是________,每生成1 mol Na2FeO4转移________mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用__________________________________
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:____________________________
________________________________________________________________________。
②每生成1 mol FeO42—转移________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铜是生物体必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式:________________________________________________________________________________________________________________________________________________。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式:________________________________________________________________________________________________________________________________________________。
(3)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,该反应的氧化剂是______________;当生成19.2 g Cu时,反应中转移的电子为__________mol。
6Cu+SO2↑,该反应的氧化剂是______________;当生成19.2 g Cu时,反应中转移的电子为__________mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜锈的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应式:________________________________________________________________________________________________________________________________________________。
(5)研究性学习小组用“间接碘量法”测定某试样CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取a g试样配成100 mL溶液,每次取25.00 mL,滴加KI溶液后有白色碘化物沉淀生成。写出该反应的离子方程式:___________________________。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗c mol/L的Na2S2O3溶液V mL。则试样中CuSO4·5H2O的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
近年来,高锰酸钾在饮用水和工业污水处理领域的消费需求增长较快。实验室可用二氧化锰为主要原料制备高锰酸钾。其部分流程如下:
(1)第①步中采用铁坩埚而不用瓷坩埚的原因是(用化学方程式表示)________________________________________。
(2)KOH、KClO3和MnO2共熔反应生成墨绿色K2MnO4的化学方程式为________________________________________。
(3)第④步通入CO2可以使MnO42—发生反应,生成MnO4—和MnO2。则K2MnO4完全反应时,转化为KMnO4的百分率约为________(精确到0.1%)。
(4)第⑤步趁热过滤的目的是______________________________________。
(5)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、________、洗涤、干燥。干燥过程中,温度不宜过高,因为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
H2O2在工业、农业、医药上都有广泛的用途。
(1)H2O2是二元弱酸,写出第一步的电离方程式 ,第二步的电离平衡常数表达式Ka2= 。
(2)许多物质都可以做H2O2分解的催化剂。一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化)。下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是 。
①I- ②Fe3+ ③Cu2+ ④Fe2+
(3)用碱性氢氧燃料电池合成H2O2,具有效率高,无污染等特点。电池总反应为:
H2 + O2 + OH- = H2O + HO2-。写出正极反应式: 。
(4)H2O2是一种环境友好的强氧化剂。电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+ 等)制备硫酸镍的一种流程如下: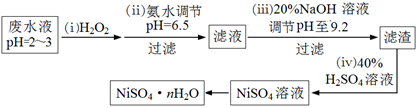
①第(ⅰ)步,加入H2O2反应的离子方程式 。
②第(ⅱ)步,滤渣中的主要成分在医疗上的用途是 。
③为测定NiSO4·n H2O的组成,进行如下实验:称取2.627g样品,配制成250.00 mL溶液。准确量取配制的溶液25.00 mL,用0.04000 mol·L-1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++ H2Y2-=NiY2-+ 2H+),消耗EDTA标准溶液25.00 mL。则硫酸镍晶体的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。
完成下列填空:
(1)某课题组模拟地下水脱氮过程,利用Fe粉和KNO3(aq)反应探究脱氮原理。实验前
①用0.1mol·L-1H2SO4(aq)洗涤Fe粉,其目的是 ,然后用蒸馏水洗涤至中性;
②将KNO3(aq)的pH调至2.5;
③为防止空气中的 (写化学式)对脱氮的影响,应向KNO3溶液中通入N2。
(2)用足量Fe粉还原上述KNO3(aq)过程中,反应物与生成物的离子浓度、pH随时间的变化关系如图所示。请根据图中信息写出t1时刻前该反应的离子方程式: 。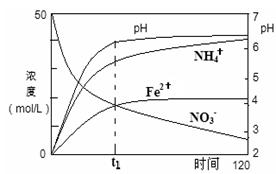
(3)神舟载人飞船的火箭推进器中常用肼(N2H4)作燃料。NH3与NaClO反应可得到肼(N2H4),该反应中被氧化与被还原的元素的原子个数之比为 。如果反应中有5mol电子发生转移,可得到肼 g。
(4)常温下向25mL 0.01mol/L稀盐酸中缓缓通入5.6 mL NH3(标准状况,溶液体积变化忽略不计),反应后溶液中离子浓度由大到小的顺序是 。在通入NH3的过程中溶液的导电能力 (填写“变大”、“变小”或“几乎不变”)。
(5)向上述溶液中继续通入NH3,该过程中离子浓度大小关系可能正确的是 (选填编号)。
a.c(Cl-)=c(NH4+)>c(H+)=c(OH-) b.c(Cl-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(Cl-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(Cl-)
(6)常温下向25mL含HCl 0.01mol的溶液中滴加氨水至过量,该过程中水的电离平衡 (填写电离平衡移动情况)。当滴加氨水到25mL时,测得溶液中水的电离度最大,则氨水的浓度为 mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com