
【题目】常温下,现有0.1mol/LNH4HCO3溶液,溶液pH为7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如图所示。下列说法不正确的是

A.NH4HCO3溶液中存在下列关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
C.向该溶液中加入少量氢氧化钠固体时,c(HCO3-)、c(NH4+)均减小
D.通过分析可知常温下Kb(NH3·H2O)<Ka1(H2CO3)
【答案】D
【解析】
A. 溶液中并且存在物料守恒:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3),故A正确;
B. 结合图象可知,溶液的pH=9时,溶液中离子浓度大小为c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-),故B正确;
C. 逐滴滴加氢氧化钠溶液时,c(HCO3)先逐渐增大,当pH大于7.8后随溶液pH增大时,铵根离子浓度逐渐减小,而此时碳酸氢根离子仍在增大,稍后才开始减小,故C正确;
D. 常温下,0.1 moI/L的NH4HCO3溶液,pH=7.8.溶液显碱性,说明碳酸氢根离子水解程度大于铵根离子,越弱越水解,则Kb(NH3H2O)>Ka1(H2CO3),故D错误;
答案选D。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用以下实验装置模拟工业炼铁的主要过程:
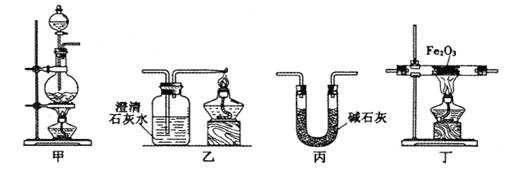
(1)装置甲中发生的反应为:HCOOH(甲酸)![]() CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该______________(填字母)。
CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该______________(填字母)。
a.将甲酸滴入浓硫酸 b.将浓硫酸滴入甲酸 c.将甲酸与浓硫酸混合后加入
(2)请按合适的顺序连接好以下装置:甲→(_____)→(_____)→(_____)
(3)丙装置中碱石灰的作用是__________________________。
(4)实验将近完成时,熄灭装置甲、乙、丁中酒精灯的先后顺序为__________。
(5)为了探究影响反应产物的外界因素,在Fe2O3,与CO反应部位,该小组同学分别用酒精灯和酒精喷灯进行了两次实验,结果如下:
加热方式 | 通CO加热时间/min | 澄清石灰水变浑浊时间/min | 产物颜色 | 产物能否全部被磁铁吸引 |
酒精灯 | 30 | 5 | 黑色 | 能 |
酒精喷灯 | 30 | 1 | 黑色 | 能 |
①甲同学猜想黑色产物中可能含有碳单质。乙同学排除了该可能,他提出的两种理由是:____、____。
②丙同学查找资料发现,Fe3O4也能被磁铁吸引,对黑色产物成分提出以下三种假设:i.全部为铁;ii.________;iii.___________。
③通过进一步定量实验,黑色产物所含元素组成和质量分数如下:
样品序号 | 加热方式 | 元素组成和质量分数 |
产物样品I | 酒精灯 | w(Fe)=74.4%、w(O)=25.6% |
产物样品II | 酒精喷灯 | w(Fe)=100% |
样品I的成分及质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的回收利用对温室气体的减排具有重要的意义。在2L密闭容器中,加入2.00molCO2和2.0 mol H2以及催化剂发生反应:CO2(g)+H2 (g)![]() HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:
HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:
60 min | 90 min | 120 min | 150 min | 180 min | ||
实验I | Tl/K | 1.50 mol | 1.32 mol | 1.28 mol | 1.26 mol | 1.26 mol |
实验Ⅱ | T2/K | 1.45 mol | 1.20 mol | 1.10 mol | 1.10 mol | 1.10 mol |
(1)比较实验温度T1___T2(填“>”、“<”),该反应的ΔH___0(填“>”、“=”、“<”)。
(2)实验I中0~60 min内用HCOOH表示的该反应的平均反应速率为_____。
(3)实验Ⅱ反应开始时体系压强为P0,第90min时体系压强为Pl,则Pl∶P0=___。
(4)比较实验I、Ⅱ在80min时的逆反应速率大小vl___vⅡ(填“>”、“<”或“无法判断”),原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的综合利用对促进“低碳经济”的发展有重要意义。CO2与H2合成二甲醚(CH3OCH3)是一种CO2转化方法,其过程中主要发生下列反应:
反应I CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1= -49.0 kJ.mol-1
CH3OH(g)+H2O(g) △H1= -49.0 kJ.mol-1
反应II 2CH3OH(g)![]() CH3OCH3(g)+H20(g) △H2=- 24.5 kJ.mol-1
CH3OCH3(g)+H20(g) △H2=- 24.5 kJ.mol-1
反应III CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=41.2 kJ.mol-1
CO(g)+H2O(g) △H3=41.2 kJ.mol-1
(1)写出CO2与H2一步合成二甲醚(反应IV)的热化学反应方程式:_______________
(2)有利于提高反应IV平衡转化率的条件是_______。
A.高温高压 B.低温诋压 C.高温低压 D.低温高压
(3)在恒压、CO2和H2起始物质的量之比为1:3的条件下,CO2平衡转化率和平衡时二甲醚的选择性随温度的变化如图1。CH3OCH3的选择性=![]()
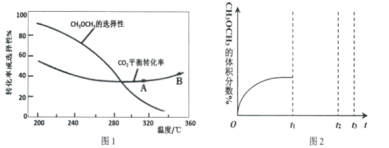
①温度低于300℃,CO2平衡转化率随温度升高而下降的原因是_____________________
②关于合成二甲醚工艺的理解,下列说法正确的是_____________
A.反应IV在A点和B点时的化学平衡常数K(A)小于K(B)
B.当温度、压强一定时,在原料气(CO2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
C.其他条件不变,在恒容条件下的二甲醚平衡选择性比恒压条件下的平衡选择性低
D.提高催化剂的活性和选择性,减少CO等副产物是工艺的关键
③在某温度下,若加入CO2的物质的量为1mol,生成二甲醚的选择性为80%,现收集到0.2mol的二甲醚,则CO2转化率为__________________
④一定温度压强下,二甲醚的体积分数随时间变化如图2所示。在t1时刻,再加入物质的量之比为1:3的CO2和H2,t2时刻重新达到平衡。画出t1—t3时刻二甲醚体积分数的变化趋势。__________________
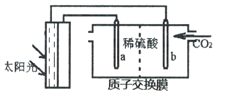
(4)光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成二甲醚的光能储存装置如图所示,则b极的电极反应式为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.3 mol·L-1 NaOH溶液480 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度 ________(填“>”、“<”或“=”)0.3 mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度________(填“ >”、“<”或“=”)0.3 mol·L-1。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm- 3的浓硫酸的体积为 ________ mL (计算结果保留一位小数)mL;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是重要的有机物,可由E和F在一定条件下合成:(部分反应物或产物省略,另请注意箭头的指向)

已知以下信息:
i.A属于芳香烃,H属于酯类化合物。
ii.I的核磁共振氢谱为二组峰,且峰的面积比为6:1。
回答下列问题:
(1)E的含氧官能团名称是 ______ ,B的结构简式是___________________。
(2)B→C和G→J两步的反应类型分别为 ___________,____________。
(3)①E+F→H的化学方程式是____________________________________。
②D与银氨溶液反应的化学方程式是__________________________________。
(4)E的同系物K比E相对分子质量大28,则K的同分异构体共 ______ 种,其中核磁共振氢谱显示为4组峰,且峰面积之比为6:2:1:1,写出符合要求的该同分异构体的结构简式为(写出1种即可) ____________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨对人类生存具有重大意义,反应为:N2(g)+3H2(g)![]() 2NH3(g) H
2NH3(g) H
(1)科学家研究在催化剂表面合成氨的反应机理,反应步骤与能量的关系如图所示(吸附在催化剂表面的微粒用*标注,省略了反应过程中部分微粒)。
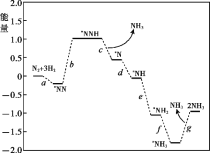
① NH3的电子式是_______。
② 写出步骤c的化学方程式_______。
③ 由图像可知合成氨反应的H______0(填“>”、“<”或“=”)。
(2)传统合成氨工艺是将N2和H2在高温、高压条件下发生反应。若向容积为1.0 L的反应容器中投入5 mol N2、15 mol H2,在不同温度下分别达平衡时,混合气中NH3的质量分数随压强变化的曲线如图所示:

① 温度T1、T2、T3大小关系是_______。
② M点的平衡常数 K = _______(可用分数表示)。
(3)目前科学家利用生物燃料电池原理(电池工作时MV2+/MV+在电极与酶之间传递电子),研究室温下合成氨并取得初步成果,示意图如下:
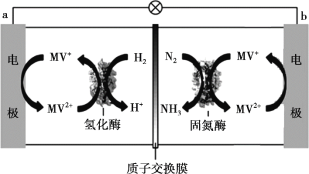
① 导线中电子移动方向是_______。
② 固氮酶区域发生反应的离子方程式是_______。
③ 相比传统工业合成氨,该方法的优点有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法不正确的是( )
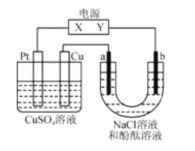
A.X极是电源正极,Y极是电源负极
B.Cu电极上增重6.4g时,b极产生4.48L(标准状况)气体
C.电解过程中CuSO4溶液的pH逐渐减小
D.a极的电极反应式为2C1--2e-=Cl2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com