
25℃时,向10mL 0.01mol/L KOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的是( )
|
| A. | pH>7时,c(C6H5O﹣)>c(K+)>c(H+)>c(OH﹣) |
|
| B. | pH<7时,c(K+)>c(C6H5O﹣)>c(H+)>c(OH﹣) |
|
| C. | V=10mL时,c(K+)=c(C6H5O﹣)>c(OH﹣)=c(H+) |
|
| D. | V=20mL时,c(C6H5O﹣)+c(C6H5OH)=2c(K+) |
考点:
离子浓度大小的比较.
分析:
根据酸碱反应后溶液的PH来分析溶液中的溶质,然后利用盐的水解和弱电解质的电离及溶液中电荷守恒来分析混合溶液中粒子浓度关系.
解答:
解:A、溶液的PH>7时溶质可能为苯酚钠或苯酚钾与KOH的混合液,则溶液中一定存在c(OH﹣)>c(H+),故A错误;
B、溶液的PH<7时溶质为苯酚钾与苯酚的混合液,且苯酚的电离程度大于苯酚钾的水解,则c(H+)>c(OH﹣),再由电荷守恒可知c(C6H5O﹣)>c(K+),故B错误;
C、当苯酚溶液10mL,二者恰好完全反应,溶液中的溶质为苯酚钾,由苯酚根离子的水解可知c(K+)>c(C6H5O﹣),故C错误;
D、当苯酚溶液20mL,苯酚的物质的量恰好为钾离子物质的量的2倍,则由物料守恒可知c(C6H5O﹣)+c(C6H5OH)=2c(K+),故D正确;
故选:D.
点评:
本题考查溶液中离子浓度大小的比较,学生明确酸碱之间的反应,准确判断溶液中的溶质并利用水解、电荷守恒、物料守恒等知识即可解答.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用石墨作阳极
D.在镀件上电镀锌,用锌作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法在一定条件下可以实现的是( )
①酸性氧化物与碱反应
②弱酸与盐溶液反应可生成强酸
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸溶液充分反应后的溶液呈中性
⑤有单质参加的非氧化还原反应
⑥两种含氧化合物反应的产物有气体.
A. ①②③④⑤⑥ B. ②④⑤⑥ C. ①②③⑤ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是( )
|
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
|
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
|
| C. | 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 |
|
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
|
| A. | FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ |
|
| B. | NO2与水的反应:3NO2+H2O═2NO3﹣+NO+2H+ |
|
| C. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
|
| D. | 向NaAlO2溶液中通入过量CO2:2AlO2﹣+CO2+3H2O═2Al(OH)3↓+CO32﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的.已知:
氧化性:IO3﹣>Fe3+>I2;还原性:S2O32﹣>I﹣
3I2+6OH﹣═IO3﹣+5I﹣+3H2O;KI+I2⇌KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①加KSCN溶液显红色,该红色物质是(用化学式表示);CCl4中显紫红色的物质 (用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 .
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.
写出潮湿环境下KI与氧气反应的化学方程式: .
将I2溶于KI溶液,在低温条件下,可制得KI3•H2O.该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由 .
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 .
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是某校实验小组设计的一套原电池装置,下列有关描述不正确的是
A.此装置能将化学能转变为电能
B.石墨电极的反应式:O2+2H2O+4e—=4OH—
C.电子由Cu电极经导线流向石墨电极
D.电池总的反应是:2Cu+O2+4HCl=2CuCl2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Al、Fe是生活中常见的金属元素。
⑴工业上以铝土矿(主要成分Al2O3·3H2O)为原料生产铝,主要包括下列过程
①将粉碎、筛选后的铝土矿溶解在氢氧化钠溶液中②通入过量二氧化碳使①所得溶液中析出氢氧化铝固体③使氢氧化铝脱水生成氧化铝④电解熔融氧化铝生成铝。写出②所涉及的离子方程式: ,蒸干AlCl3溶液不能得到无水AlCl3,若使SOCl2与AlCl3·6H2O混合并加热,可得到无水AlCl3,用化学方程式解释:
⑵铁在地壳中的含量约占 5 %左右。铁矿石的种类很多,重要的有磁铁矿石、赤铁矿石等。红热的铁能跟水蒸气反应,则其反应的化学方程式为 。其生成黑色的物质溶于酸后,加入KSCN,见不到血红色产生,其原因是 、
(用离子方程式解释)工业炼铁常用赤铁矿与Al在高温下反应制备,写出方程式: 。
⑶钠的化合物中,其中纯碱显碱性的原因: ,(用方程式解释)向饱和的纯碱溶液中通入过量的二氧化碳有晶体析出,写出离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行反应CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是( )
CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是( )
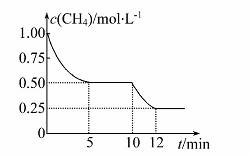
A.10 min时,改变的外界条件可能是升高温度
B.0~10 min内,v(H2)=0.15 mol·L-1·min-1
C.恒温下,缩小容器体积,一段时间内v(逆)>v(正)
D.12 min时,反应达平衡的本质原因是气体总质量不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com