
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法不正确的是(NA为阿伏加德罗常数的值)
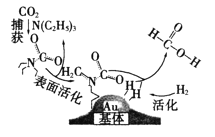
A.10.1gN(C2H5)3中所含的共价键数目为2.1NA
B.标准状况下,22.4LCO2中所含的电子数目为16NA
C.在捕获过程中,二氧化碳分子中的共价键完全断裂
D.100g 46%的甲酸水溶液中所含的氧原子数目为5NA
科目:高中化学 来源: 题型:
【题目】氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42—)中回收氧化铁流程如图所示:

已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生反应的离子方程式:_____,指出使用空气的优点是:_______。
(2)已知Fe3+(aq)+3OH-(aq)===Fe(OH)3(s) ΔH=-Q1 kJ/mol,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=______。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=_________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是_____(填化学式,下同),用____试剂可将其除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HA溶液所得滴定曲线如图。下列说法不正确的是

A.HA的电离平衡常数Ka=10-5
B.点①所示的溶液中:2c(Na+)=c(A-)+c(HA)
C.点③所示的溶液中:c(HA)>c(OH-)-c(H+)
D.点④所示的溶液中:2c(OH-)-2c(H+)=c(A-)+3c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是( )
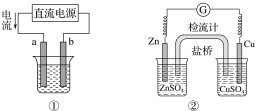
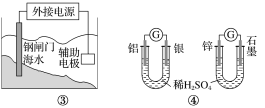
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗是意大利化学家(1776.08.09-1856.07.09),曾开业当律师,24岁后弃法从理,十分勤奋,终成一代化学大师。为了纪念他,人们把1 mol某种微粒集合体所含有的粒子个数,称为阿伏加德罗常数,用N![]() 表示。下列说法或表示中不正确的是
表示。下列说法或表示中不正确的是

A.科学上规定含有阿伏加德罗常数个粒子的任何微粒集合体都为1 mol
B.在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA
C.60 克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2
D.6.02×1023mol-1 叫做阿伏加德罗常数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下3个热化学方程式:
H2(g)+![]() O2(g)=H2O(g) ΔH1= -a kJ·mol-1①
O2(g)=H2O(g) ΔH1= -a kJ·mol-1①
H2(g)+![]() O2(g)=H2O(l) ΔH2= -b kJ·mol-1②
O2(g)=H2O(l) ΔH2= -b kJ·mol-1②
2H2(g)+O2(g)=2H2O(l) ΔH3= -c kJ·mol-1③
则由下表所列的原因能推导出后面结论的是( )
选项 | 原因 | 结论 |
A | H2的燃烧是放热反应 | a、b、c均大于零 |
B | ①和②中物质的化学计量数均相同 | a=b |
C | ①和③中H2O的状态不同,化学计量数不同 | a、c不会有任何关系 |
D | ③的化学计量数是②的2倍 | ΔH2<ΔH3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铝铵[NH4Al(SO4)2]是一种重要的分析试剂,下列有关说法正确的是( )
A.硫酸铝铵中Al3+的水解程度比明矾中Al3+的水解程度大
B.该物质的水溶液中Na+、K+、Cl-、S2-都可大量共存
C.向该物质的溶液中滴加同浓度的NaOH溶液的体积与生成沉淀的关系如图

D.向该物质的溶液中滴加Ba(OH)2溶液,使SO42-恰好完全沉淀的离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图,下列说法不正确的是( )
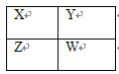
A.Y的气态氢化物的稳定性一定比W的强
B.W的原子序数可能是Y的原子序数的2倍
C.Y原子形成的简单离子半径一定比X原子形成的简单离子半径大
D.若Z元素最高价氧化物的水化物是强酸,则W元素的单质具有强氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com