
| A.只有① | B.只有④ |
| C.只有②③④ | D.只有①②③ |
 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源:不详 题型:计算题
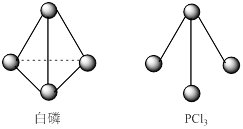
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
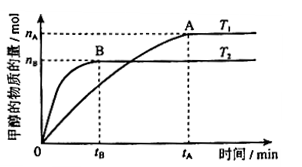
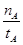 mol·L-1·min-1
mol·L-1·min-1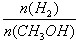 增大
增大查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CO2(g)反应过程的能量变化如图所示。已知1 mol CO (g)氧化为1 mol CO2 (g)的ΔH =-283 kJ/mol。请回答下列问题:
2CO2(g)反应过程的能量变化如图所示。已知1 mol CO (g)氧化为1 mol CO2 (g)的ΔH =-283 kJ/mol。请回答下列问题:
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
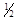 O2(g)==H2O(l);△H = -285.8kJ/mol,由此可知,在等温下蒸发45g液态水需吸收____________kJ的热量。
O2(g)==H2O(l);△H = -285.8kJ/mol,由此可知,在等温下蒸发45g液态水需吸收____________kJ的热量。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.12:3.25 | B.3.25:12 | C.1:1 | D.6:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g);△H=-Q kJ·mol-1(Q>0),向密闭恒容容器甲中通入l mol SO2和0.5 mol O2,向另一密闭恒容容器乙中通入2 mol SO2和1 mol O2,起始时两容器中气体的温度和压强相同,反应达到平衡时,两容器中气体的温度和压强仍相同,此时甲中放出的热量为Ql kJ,乙中放出的热量为Q2 kJ。则下列关系式正确的是 ( )
2SO3(g);△H=-Q kJ·mol-1(Q>0),向密闭恒容容器甲中通入l mol SO2和0.5 mol O2,向另一密闭恒容容器乙中通入2 mol SO2和1 mol O2,起始时两容器中气体的温度和压强相同,反应达到平衡时,两容器中气体的温度和压强仍相同,此时甲中放出的热量为Ql kJ,乙中放出的热量为Q2 kJ。则下列关系式正确的是 ( )| A.2Q1=Q2<Q | B.2Ql<Q2<Q |
| C.2Q1=Q2=Q | D.Q1<Q2=Q |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-1648.8KJ/mol | B.-824.4KJ/mol | C.+1648.8KJ/mol | D.-744.7KJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com