
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2)]是分析化学中的重要试剂,在隔绝空气加热至500℃时能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。某化学小组选用下图所示装置进行实验(夹持装置略),探究此反应产物。
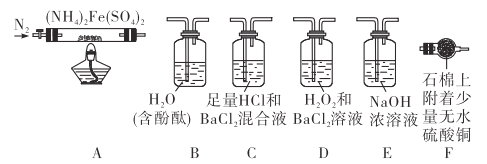
(1)甲同学根据可能生成的气体产物,设计下列实验:
操作步骤 | 实验现象 | 结论或解释 |
①按______________的顺序组装仪器并进行实验 | ②___________ | 气体产物中既有H2O ,也有NH3 |
③按A、C、D、E的顺序组装仪器并进行实验,其中装置C的作用是____________ | C中无明显现象,D中生成白色沉淀 | ④D中发生反应的离子方程式为___________ |
(2)乙同学称取14.20g硫酸亚铁铵固体,隔绝空气加热至500℃ 时使其完全分解,冷却后称得固体质量为4.00g,则所得固体产物的化学式为_____。(硫酸亚铁铵的摩尔质量为284g·mol-1)
(3)实验证明:(NH4)2Fe(SO4)2受热分解除生成上述产物外,还有N2生成,写出硫酸亚铁铵在隔绝空气的条件下加热至500℃时的分解反应方程式_____________________________________。
【答案】A、F、E、B F中无水硫酸铜变蓝,B中溶液变红 吸收NH3,验证是否含有SO3 SO2+H2O2+Ba2+ = BaSO4↓+2H+ Fe2O3 2(NH4)2Fe(SO4)2![]() Fe2O3+2NH3↑+N2↑+4SO2↑+5H2O
Fe2O3+2NH3↑+N2↑+4SO2↑+5H2O
【解析】
硫酸亚铁铵[(NH4)2Fe(SO4)2]在隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。
(1)要验证气体产物中既有H2O,也有NH3,可以用F中无水硫酸铜变蓝色证明生成水,B中溶液变红说明生成氨气,需要用E除去硫的氧化物;
按ACDE的顺序组装仪器,通过装置C中的足量盐酸和氯化钡溶液中,C中无明显现象说明无三氧化硫,D中生成白色沉淀, D中过氧化氢氧化二氧化硫生成硫酸,和氯化钡溶液反应生成硫酸钡沉淀;
(2)首先计算14.20g硫酸亚铁铵固体的物质的量,求出铁元素的物质的量,根据常见铁的氧化物有氧化铁、氧化亚铁、四氧化三铁,结合铁的氧化物质量4.00g计算判断;
(3)反应的生成物有NH3、SO2、Fe2O3、H2O、N2,结合元素守恒和得失电子守恒配平反应的化学方程式。
(1)硫酸亚铁铵[(NH4)2Fe(SO4)2]在隔绝空气加热至500℃时硫酸亚铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。在A中先通入氮气排净装置中的空气,然后加热分解硫酸亚铁铵。根据装置图中的药品可知,装置B可以检验氨气;装置C可以检验生成的产物中是否含有三氧化硫,装置D可以将二氧化硫氧化生成三氧化硫,装置E浓氢氧化钠溶液可以吸收硫的氧化物,装置F中无水硫酸铜可以检验生成的水。
要验证气体产物中既有H2O,也有NH3,可以按照装置顺序AFEB连接,F中无水硫酸铜变蓝色证明生成水,B中溶液变红说明生成氨气;
按A、C、D、E的顺序组装仪器并进行实验,通过装置C中的足量盐酸和氯化钡溶液中,C中无明显现象说明无三氧化硫,D中生成白色沉淀,D中过氧化氢氧化二氧化硫生成硫酸,硫酸和氯化钡溶液反应生成硫酸钡沉淀,反应的离子方程式为:SO2+H2O2+Ba2+=BaSO4↓+2H+;
故答案为:A、F、E、B;F中无水硫酸铜变蓝,B中溶液变红;吸收NH3,验证是否含有SO3;SO2+H2O2+Ba2+ = BaSO4↓+2H+;
(2)称取14.20g硫酸亚铁铵固体,物质的量=![]() =0.05mol,铁元素物质的量为0.05mol,铁常见氧化物为氧化铁、氧化亚铁、四氧化三铁,其相对分子质量分别为160、72、232。隔绝空气加热至500℃时使其完全分解,冷却后称得固体质量为4.00g,0.05mol铁元素若为Fe2O3,物质的量为0.025mol,质量=0.025mol×160g/mol=4.0g,FeO质量=0.05mol×72g/mol=3.6g,若为Fe3O4的质量=
=0.05mol,铁元素物质的量为0.05mol,铁常见氧化物为氧化铁、氧化亚铁、四氧化三铁,其相对分子质量分别为160、72、232。隔绝空气加热至500℃时使其完全分解,冷却后称得固体质量为4.00g,0.05mol铁元素若为Fe2O3,物质的量为0.025mol,质量=0.025mol×160g/mol=4.0g,FeO质量=0.05mol×72g/mol=3.6g,若为Fe3O4的质量=![]() ×0.05mol×232g/mol=3.9g,故固体为氧化铁,故答案为:Fe2O3;
×0.05mol×232g/mol=3.9g,故固体为氧化铁,故答案为:Fe2O3;
(3)实验可知反应的生成物有NH3、SO2、Fe2O3、H2O、N2,结合元素守恒和得失电子守恒配平的2(NH4)2Fe(SO4)2![]() Fe2O3+2NH3↑+N2↑+4SO2↑+5H2O,故答案为:2(NH4)2Fe(SO4)2
Fe2O3+2NH3↑+N2↑+4SO2↑+5H2O,故答案为:2(NH4)2Fe(SO4)2![]() Fe2O3+2NH3↑+N2↑+4SO2↑+5H2O。
Fe2O3+2NH3↑+N2↑+4SO2↑+5H2O。


科目:高中化学 来源: 题型:
【题目】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去)。当X是强碱时, B能使湿润的红色石蕊试纸变蓝。下列说法中不正确的是
![]()
A. 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B. 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C. B和Cl2的反应是氧化还原反应
D. 当X是强酸时,C在常温下是气态单质
查看答案和解析>>
科目:高中化学 来源: 题型:
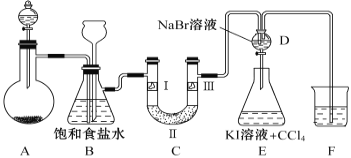
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备和A中加热装置已省略)。
请回答:
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,相关反应的化学方程为________________。
(2)装置B中饱和食盐水的作用是____________。同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象___________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入_______。
选项 | Ⅰ | Ⅱ | Ⅲ |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 硅胶 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)装置F烧杯中盛放的试剂是_______________。
(5)设计装置D、E的目的是比较Cl2、Br2、I2的氧化性强弱。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为橙黄色,说明Cl2的氧化性大于Br2。打开装置D的活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是________________________________________。该现象_____________(填“能”或“不能”)说明Br2 的氧化性强于I2 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A的分子式为C9H15OCl,分子中含有一个六元环和一个甲基,环上只有一个取代基;F分子中不含甲基:A与其它物质之间的转化如下图所示:

(1)A-F的反应类型是____;G中含氧官能团的名称是____。
(2)A-C的反应方程式是________。
(3)H的结构简式是________,E的结构简式是____。
(4)有的同学认为B中可能没有氯原子,你的观点是________(填“同意”或“不同意”)你的理由_______。
(5)某烃的含氧衍生物X符合下列条件的同分异构体中,核磁共振氢谱显示为2组峰的是_____(写结构简式);只含有两个甲基的同分异构体有____种。
①相对分子质量比C少54;②氧原子数与C相同 ; ③能发生水解反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式_______。
(2)Li2Ti5O15中过氧键的数目为4,其中Ti的化合价为______。
(3)若“滤液②”中c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe2+恰好沉淀完全即溶液中c(Fe3+)=1×10-5mol/L,此时_____(填“有”或“无”)Mg3(PO4)2沉淀生成。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-2、1.0×10-2。
(4)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式_________。
(5)TiO2·xH2O加热制得的粗TiO2是电解法生产金属钛的一种较先进的方法,电解液为某种可传导02-离子的熔融盐,原理如图所示,则其阴极电极反应为:_______,电解过程中阳极电极上会有气体生成,该气体可能含有____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将碳酸钠和碳酸氢钠的固体混合物Wg溶于水制成500mL溶液,钠离子的物质的量浓度为0.8mol·L-1,若将Wg该混合物用酒精灯加热至质量不再改变时,得到的固体物质的质量可能是
A. 21.2g B. 6.2g C. 8.4g D. 10.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL 18mol/L的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量
A. 小于0.45mo1B. 等于0.45molC. 在0.45mol和0.9mol之间D. 大于0.9mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 用湿润的pH试纸测定NaCl 溶液的pH时会影响测定结果
B. 检验某溶液含有NH4+:取试样少许于试管中,加入足量NaOH溶液加热,用湿润红色石蕊试纸检验变蓝
C. 液溴保存时液面覆盖一层水,装在带橡胶塞的细口试剂瓶中
D. 配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就定容,所配制的溶液浓度偏小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com