
在盐类发生水解的过程中,正确的说法是( )
A.盐的电离平衡被破坏
B.水的电离程度逐渐增大
C.溶液的pH发生了较大改变
D.生成的弱电解质
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列反应属于氧化还原反应的是( )
A.CaCO3+2HCl=CaCl2+CO2↑ + H2O B.CaO+H2O=Ca(OH)2
C.2H2O2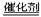 2H2O+O2↑ D.CaCO3
2H2O+O2↑ D.CaCO3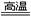 CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
关于Na2CO3和NaHCO3比较中,下列说法不正确的是
A.NaHCO3固体受热容易分解,而Na2CO3固体受热不容易分解
B.等质量的Na2CO3和NaHCO3分别与足量的盐酸反应,前者消耗盐酸的物质的量比后者多
C.等物质的量浓度的Na2CO3和NaHCO3溶液分别滴加2滴酚酞试液,前者颜色比后者深
D.Na2CO3溶液和NaHCO3溶液分别与Ba(OH)2溶液反应的离子方程式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是
( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO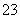 )均增大
)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,下列关于pH均为9、体积均为10 mL的NaOH溶液和CH3COONa溶液的比较说法正确的是( )
A.两种溶液中的c(Na+)相等
B.分别加热到相同温度时,CH3COONa溶液的pH小
C.分别加水稀释到100 mL时,两种溶液的pH依然相等
D.两溶液中由水电离出的c(OH-)之比为10-9/10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
铁、铜单质及其化合物应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
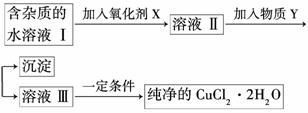
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂的目的是__ ______________________。
______________________。
(2)最适合作氧化剂X的是__________。
A.K2Cr2O7 B.NaClO
C.H2O2 D.KMnO4
(3)加入的物质Y是__________。
(4)若不用物质Y而是直接用碱能不能达到目的?______(填“能”或“不能”)。若能,不用回答;若不能,试解释原因
_________________________________________ _______________________________。
_______________________________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________(填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作?____________________________________。
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是______________________________。
( 7)若向溶液Ⅱ中加入镁粉,产生的气体是____________。试解释原因____________________________________________________。
7)若向溶液Ⅱ中加入镁粉,产生的气体是____________。试解释原因____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组用下列装置进行乙醇催化氧化的实验。
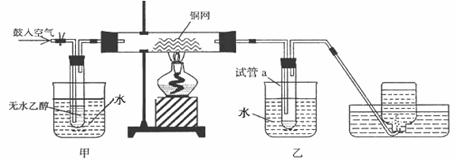
(1)、实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式:
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,
说明该乙醇催化反应是_____ 反应。
(2)、甲和乙两个水浴作用不相同。
甲的作用是____________; 乙的作用是_______________。
(3)、反应进行一段时间后,干燥试管a中能收集到不同的物质,
它们是 __。
集气瓶中收集到的气体的主要成分是____________ 。
(4)、试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有________________ 。
要除去该物质,可在混合液中加入_____________(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过___________________(填实验操作名称)即可除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O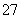 和CrO
和CrO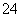 ,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
CrO
 Cr2O
Cr2O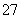
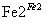 Cr3+
Cr3+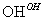 Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:
2CrO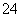 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O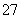 (橙色)+H2O
(橙色)+H2O
(1)若平衡体系的 pH = 2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是________。
a.Cr2O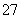 和CrO
和CrO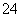 的浓度相同
的浓度相同
b.2v(Cr2O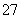 )=v(CrO
)=v(CrO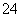 )
)
c.溶液的颜色不变
(3)第②步中,还原 1 mol Cr2O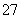 离子,需要________mol的FeSO4·7H2O。
离子,需要________mol的FeSO4·7H2O。
(4)第 ③步生成的Cr(OH)3 在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)  Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3 的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使 c(Cr3+)降至10-5mol/L,溶液的pH应调至________。
方法2:电解法
该法用 Fe 做电极电解含Cr2O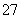 的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3 沉淀。
的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3 沉淀。
(5)用Fe做电极的原因为_____________________ _______________________。
_______________________。
(6)在阴极附近溶液 pH 升高的原因是(用电极反应解释)________,溶液中同时生成的沉淀还有________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com