
【题目】(1)联氨(又称肼,N2H4,无色液体)为二元弱碱,在水中的电离方式与氨相似。写出在水中联氨第一步电离反应的方程式_______________。氯化镁溶液在某条件下可生Mg(OH)Cl沉淀,请写出相关离子方程式_________
(2)实验室可通过向盛装有碱石灰的锥形瓶中滴加浓氨水来制取氨气,请利用相关化学反应原理来解释______________________________
(3)室温下向10mL0.1 mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示

则HA为_______电解质(填“强”或“弱”),a点所示溶液c(Na)_____c(A)(填“>”、“<”或“”=),a、b两点所示溶液中水的电离程度a_______b(填“>”、“<”或“"=)。
(4)25℃时0.05mol/L的醋酸溶液,pH=______ 该溶液中水电离出的c(H+)=____(已知室温下醋酸电离平衡常数为2.0×10-5)
(5)常温下,0.01mol/L的HCN溶液加水稀释1000倍的过程中,下列选项增大的是_____
A.![]() B.Kac(HCN) C.
B.Kac(HCN) C.![]() D.
D.![]()
【答案】N2H4+H2ON2H5++OH- Mg2++ Cl -+H2O+![]()
![]() Mg(OH)Cl+H+ 在氨水中存在平衡:NH4++OH-NH3H2ONH3+H2O,氧化钙和生石灰吸水或与水反应放出热量,使温度升高,且氢氧根浓度增大,均使上述平衡向右移动,促使氨水分解成氨气 弱 > > 3 10-11mol/L AC
Mg(OH)Cl+H+ 在氨水中存在平衡:NH4++OH-NH3H2ONH3+H2O,氧化钙和生石灰吸水或与水反应放出热量,使温度升高,且氢氧根浓度增大,均使上述平衡向右移动,促使氨水分解成氨气 弱 > > 3 10-11mol/L AC
【解析】
结合氨气在溶液中的电离特点可知第一步电离出N2H5+、OH-,据此写联氨第一步电离方程式;碱石灰和水反应生成氢氧化钙且放出热量,NaOH溶解放出热量,升高温度促进一水合氨分解生成氨气;关于滴定曲线的分析, a点时溶质为NaA,显碱性,说明A-水解,b点为HA、NaA等浓度混合溶液,显酸性,说明以电离为主;加水稀释,促进HCN的电离,由于溶液体积增大的程度大于氢离子物质的量的增大程度,所以c(H+)减小,则c(OH -)增大,再分析其他微粒以及比值变化。
(1)联氨为二元弱碱,在水中的电离方式与氨相似,其第一步电离出N2H5+、OH-,联氨第一步电离方程式为:N2H4+H2ON2H5++OH-;MgCl2溶液水解可生成Mg(OH)Cl和HCl,依据原子守恒书写化学方程式为:MgCl2+ H2O![]()
![]() Mg(OH)Cl+HCl↑,离子方程式为:Mg2++ Cl-+H2O+
Mg(OH)Cl+HCl↑,离子方程式为:Mg2++ Cl-+H2O+![]()
![]() Mg(OH)Cl+H+;故答案为:N2H4+H2ON2H5++OH-;Mg2++ Cl-+H2O+
Mg(OH)Cl+H+;故答案为:N2H4+H2ON2H5++OH-;Mg2++ Cl-+H2O+![]()
![]() Mg(OH)Cl+H+;
Mg(OH)Cl+H+;
(2)在氨水中存在平衡:NH4++OH-NH3H2ONH3+H2O,向盛装有碱石灰的锥形瓶中滴加浓氨水,碱石灰中的氧化钙与水反应,且放热,碱石灰中的氢氧化钠吸水也会放热,体系温度升高,且氢氧根浓度增大,使上述平衡向右移动,促进氨水分解生成氨气;故答案为:在氨水中存在平衡:NH4++OH-NH3H2ONH3+H2O,氧化钙和生石灰吸水或与水反应放出热量,使温度升高,且氢氧根浓度增大,均使上述平衡向右移动,促使氨水分解成氨气;
(3)a点时溶质为NaA,而此时溶液显碱性,说明A-水解,证明HA是弱酸;a点时溶质为NaA,而 A-部分水解,溶液呈碱性,则c(Na+)>c(A-);a点A-水解,促进水的电离,b点时HA过量,溶液呈酸性,HA电离出H+,抑制水的电离,a、b两点所示溶液中水的电离程度a>b;故答案为:弱,>,>;
(4)醋酸的电离常数Ka=![]() =2.0×10-5,c(H+)=1×10-3mol/L,pH=3;该溶液中Kw= c(H+)c(OH-)水,则c(OH-)水=
=2.0×10-5,c(H+)=1×10-3mol/L,pH=3;该溶液中Kw= c(H+)c(OH-)水,则c(OH-)水=![]() ==10-11mol/L,而水电离的氢离子等于水电离的氢氧根,故c(H+)水=10-11mol/L,故答案为:3;10-11mol/L;
==10-11mol/L,而水电离的氢离子等于水电离的氢氧根,故c(H+)水=10-11mol/L,故答案为:3;10-11mol/L;
(5)加水稀释,促进HCN的电离,由于溶液体积增大的程度大于氢离子物质的量的增大程度,所以c(H+)减,则c(OH -)增大;
A、根据电荷守恒,c(H+)=![]() ,稀释时c(H+)减小,所以
,稀释时c(H+)减小,所以![]() 增大,A正确;
增大,A正确;
B、稀释时Ka不变,c(HCN)减小,因此Kac(HCN)减小,B错误;
C、稀释时,c(H+)和c(HCN)都减小,但是由于电离平衡向右移动,c(HCN)减小程度大于c(H+),所以![]() 增大,故C正确;
增大,故C正确;
D、![]()
![]() ,而Ka和Kw都不变,所以
,而Ka和Kw都不变,所以![]() 不变,故D错误。答案为:AC。
不变,故D错误。答案为:AC。


 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法错误的是( )
A.1L0.2mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.2NA
B.H2O2+Cl2=2HCl+O2反应中,每生成32gO2,转移2NA个电子
C.3.6gCO和N2的混合气体含质子数为1.8NA
D.常温常压下,30g乙烷气体中所含共价键的数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法正确的是( )
A.16.25gFeCl3水解形成的Fe(OH)3胶体粒子数小于0.1NA
B.22.4L(标准状况)氩气含有的分子数为0.5NA
C.标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
D.2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是

A.恒温恒容下,再向B点体系充入N2O4,NO2的体积分数增大
B.图中A、C两点气体的颜色:A浅,C深
C.图中A、C两点气体的平均相对分子质量:A>C
D.温度T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题
(1)煤的气化的主要化学反应方程式为________________
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为____________
(3)利用水煤气合成二甲醚的三步反应如下
①2H2(g)+CO(g)=CH3OH(g) △H=-90.8kJ.mo-1
②2CH3OH(g)= CH3OCH3(g)+ H2O(g) △H=-235kJ.mo-1
③CO(g)+H2O(g)=O2(g)+H2(g) △H=-413kJ.mo-1
总反应:3H2(g)+3CO(g)= CH3OCH3(g)+CO2(g)的△H=___________
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是____(填字母代号)![]()
a. 高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加Co的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)= CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400.此温度下,在2L密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
物质的量(mol) | 0.88 | 1.2 | 1.2 |
①加入的CH3OH的起始浓度为_________
②比较此时正、逆反应速率的大小:v正________v逆(填少”、“<”或“=”)
③若加入CH3OH后,经10min反应达到平衡,此时CH3OH的转化率a(CH3OH)=_________c(CH3OCH3)=____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性、高效催化性等优良的性质。
Ⅰ.实验室采用气相还原法制备纳米级Fe,其流程如图所示::
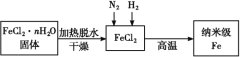
(1)纳米级Fe和稀盐酸反应的离子方程式为_____。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2:____(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为____。
Ⅱ.查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用图甲所示装置进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。

(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是_____。
(5)甲装置中仪器a的名称为_____。
(6)丁同学称取5.60gFe粉,用乙装置反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为_____(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 向氨水中通入过量SO2:NH3·H2O+SO2===NH4++HSO3-
B. Si与NaOH溶液反应:Si+2OH-+H2O===SiO32-+H2↑
C. 电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D. Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是

A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com