
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
①1 L 0.1 mol·![]() NH4Cl溶液中,
NH4Cl溶液中,![]() 的数量为0.1 NA
的数量为0.1 NA
②0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2 NA
③标准状况下,22.4 L二氯甲烷的共价键数为7NA个
④一定条件下,2 mol SO2和1 mol O2混合在密闭容器中充分反应后容器中的分子数大于2 NA
⑤31g白磷P4中含P—P单键数目为6NA
⑥2 mL 0.5 mol/L FeCl3溶液滴入沸水中制备Fe(OH)3胶体,所得胶粒数目小于0.001 NA
A. ①④⑥ B. ②④⑥ C. ②④⑤ D. ②③⑥
【答案】B
【解析】
①铵根离子发生水解,NH4+的数目小于0.1NA,故①错误;
②H2+I2=2HI这是一个反应前后分子物质的量不变的反应,故反应后分子总数仍为0.2NA,故②正确;
③标准状况下,二氯甲烷为液体,不能使用气体摩尔体积22.4L/mol,22.4L二氯甲烷的物质的量远远大于1mol,故③错误;
④SO2与氧气反应生成三氧化硫的反应是可逆反应,则一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA,故④正确;
⑤1mol白磷分子中含6molP-P键;31g白磷晶体物质的量=31g/124g/mol=0.25mol,分子中含有的P-P键数约是1.5NA,故⑤错误;
⑥一个Fe(OH)3胶粒是多个氢氧化铁的聚集体,故将2mL0.5mol/L的FeCl3溶液滴入沸水中制成Fe(OH)3胶体,所得体系中胶粒的数目小于0.001NA,故⑥正确。
所以正确的是②④⑥,故B正确。
故选B。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式________________。
为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有_____________(写出两条)。
(2) “浸渣”中除含有某种有磁性的物质外,还含有的物质是_____(写化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是__________。然后再调节溶液的pH约为5,目的是______________。
(4)“粗硼酸”中的主要杂质是________(填名称)。
(5)单质硼可用于生产具有优良抗冲击性能的硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程_____________、 _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.用向上排空气法收集氢气B.往燃着的酒精灯中添加酒精
C.用丁达尔现象鉴别胶体和溶液D.稀释浓硫酸时,将水沿器壁慢慢注入酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是
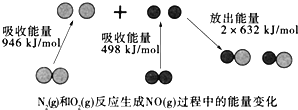
A. 该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180kJ·mol﹣1
B. 1mol N2(l)和NA个O2(l)反应生成2mol NO(g)时,吸收的能量为180kJ
C. 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为验证SO2的还原性和Fe3+的氧化性,特邀你参与以下探究活动。
I.理论预测
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的
(1)确定选择SO2和FeCl3溶液的反应而不选择SO2和Fe(NO3)3溶液的反应来探究,你认为可能是基于什么原因作出的选择:_______________________________________。
(2)将SO2通入FeCl3溶液中,你认为可能观察到的现象是:______________________,你预测的理论依据是(用离子方程式表示):___________________________________。
II.实验探究
(1)配制1mol·L-1FeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:_________。
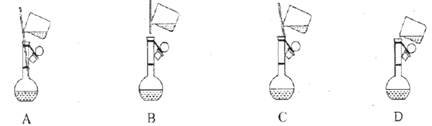
②检测得知溶液呈酸性,其原因是:___________________________(用离子方程式表示)。
(2)将SO2通入FeCl3溶液至饱和,观察到溶液由棕黄色变为红棕色,并没有观察到预期的现象。将反应后的溶液放置12小时后又出现了预期的结果。
查阅资料得知:[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:_____________________________________。
(3)为了探究如何缩短红棕色变为预期颜色的时间,小组继续探究:另取少量FeCl3溶液,再通入SO2,溶液变为红棕色,加浓HCl酸化,几分钟后变为预期颜色。请你推测小组在实验方案设计中“加浓HCl酸化”的目的是:_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
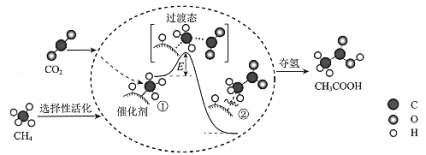
下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. 该催化剂可有效提高反应物的平衡转化率
C. ①→②放出能量并形成了C-C键
D. CH4→CH3COOH过程中,有C-H键发生断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl溶于水配成1 mol·L-1的溶液,溶解过程如图所示,下列说法正确的是

A. a离子为Na+
B. 溶液中含有NA个Na+
C. 水合b离子的图示不科学
D. 室温下测定该NaCl溶液的pH小于7,是由于Cl-水解导致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,其放电时的原电池反应:![]() 根据此反应判断,下列叙述中正确的是
根据此反应判断,下列叙述中正确的是![]()
![]()
A. Pb是正极
B. ![]() 得电子,被氧化
得电子,被氧化
C. 电池放电时,溶液的酸性增强
D. 负极反应是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环结构中,不存在单、双键交替结构,下列可以作为证据的事实是( )
![]() 苯不能使酸性高锰酸钾溶液褪色
苯不能使酸性高锰酸钾溶液褪色
![]() 苯中所有碳碳键的键长均相等
苯中所有碳碳键的键长均相等
![]() 苯与氢气在催化剂存在的条件下加热能发生加成反应生成环己烷
苯与氢气在催化剂存在的条件下加热能发生加成反应生成环己烷
![]() 经实验测得邻二甲苯只有一种结构
经实验测得邻二甲苯只有一种结构
![]() 苯在溴化铁存在的条件下与液溴发生取代反应,但不能因化学变化而使溴水褪色
苯在溴化铁存在的条件下与液溴发生取代反应,但不能因化学变化而使溴水褪色
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com