
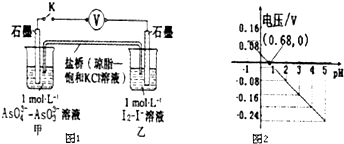
| A. | 调节pH可以改变反应的方向 | |
| B. | pH=0.68 时,反应处于平衡状态 | |
| C. | pH=5 时,负极电极反应式为2I--2e-═I2 | |
| D. | pH>0.68时,氧化性I2>AsO${\;}_{4}^{3-}$ |
分析 A、根据图2分析电压与PH的关系;
B、pH=0.68时,电压为零;
C、pH=5时,电压小于0,反应逆向进行,AsO33-在负极失电子;
D、pH>0.68时,电压小于0,反应逆向进行.
解答 解:A、由图2可知,pH>0.68时,电压小于0,反应逆向进行,pH<0.68时,电压大于0,反应正向进行,所以调节pH可以改变反应的方向,故A正确;
B、pH=0.68时,电压为零,反应处于平衡状态,故B正确;
C、pH=5时,电压小于0,反应逆向进行,AsO33-在负极失电子,则负极电极反应式为AsO33--2e-+H2O=AsO43-+2H+,故C错误;
D、pH>0.68时,电压小于0,反应逆向进行,碘作氧化剂,所以氧化性I2>AsO43-,故D正确.
故选C.
点评 本题考查了原电池原理的应用和化学平衡移动,侧重于知识的综合应用的考查,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁钉在空气中出现红色的铁锈,其负极反应式为:Fe-3e-═Fe3+ | |
| B. | 氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+NH4+═Mg2++NH3•H2O | |
| C. | 向足量铝粉与氢氧化钠溶液反应后的溶液中滴加碳酸氢钠溶液:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- | |
| D. | 漂白粉溶液中加氯化亚铁溶液产生大量沉淀:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+ Na+ Al3+ Ag+ Ba2+ |
| 阴离子 | OH- Cl- CO32- NO3- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
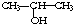 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2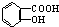 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备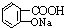
| A. | 只有①③④ | B. | 只有①④ | C. | 只有① | D. | 都不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
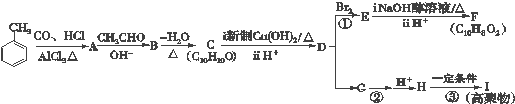
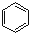 $→_{AlCl_{3}△}^{CO、HCl}$
$→_{AlCl_{3}△}^{CO、HCl}$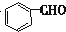
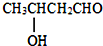 $→_{△}^{-H_{2}O}$CH3CH=CHCHO
$→_{△}^{-H_{2}O}$CH3CH=CHCHO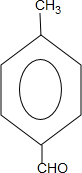 .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ +nH2O.
+nH2O.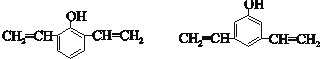 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L甲醛完全燃烧产生NA个CO2分子 | |
| B. | 1L1mol/L Na2CO3溶液中,阴离子个数等于NA | |
| C. | 100 g 98%的浓硫酸中含氧原子个数为4NA | |
| D. | 常温常压下,1mol白磷中含有共价键为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2与足量Fe反应,转移的电子数为3NA | |
| B. | 1.5molNO2与足量H2O反应,转移的电子数为1.5NA | |
| C. | 常温常压下,46gNO2和N2O4混合气体含有的原子数为3NA | |
| D. | 含有H2SO41mol的浓硫酸与足量铜反应,生成SO2的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com