
某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是 ( )
A.该温度高于25°C
B.由水电离出来的H+的浓度是1.0×10-10 mol/L
C.加入NaHSO4晶体抑制了水的电离
D.该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性
科目:高中化学 来源:2014年高考化学苏教版总复习 9-3 人工合成有机化合物练习卷(解析版) 题型:选择题
下列有关说法正确的是( )
A.凡含有食品添加剂的食物对人体健康均有害,不宜食用
B.可用米汤检验含碘盐中的碘酸钾(KIO3)
C.涤纶、绵纶、棉花、羊毛、蚕丝等都是天然纤维素
D.纤维素属于糖类,不能够直接被消化成为人体的营养物质
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
已知AgI为黄色沉淀,AgCl为白色沉淀。25°C时,AgI饱和溶液中c(Ag+)为1.22×10-8mol·L-1,AgCl饱和溶液中c(Ag+)为1.30×10-5mol·L-1。若在5 mL含有KCl和KI浓度均为0.01 mol·L-1的混合溶液中,滴加8 mL 0.01mol·L-1的AgNO3溶液,则下列叙述中不正确的是 ( )
A.溶液中所含溶质的离子浓度大小关系为: c(K+)>c(NO3—)>c(Cl-)>c(I-)>c(Ag+)
B.溶液中先产生的是AgI沉淀
C.AgCl的Ksp的数值为1.69×10-10
D.若在AgI悬浊液中滴加少量的KCl溶液,黄色沉淀不会转变成白色沉淀
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:选择题
下列离子方程式中,能正确表示盐的水解反应的是( )
A.NH4++H2O NH3·H2O+H+
NH3·H2O+H+
B.Fe3++3H2O Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
C.S2-+2H2O H2S+2OH-
H2S+2OH-
D.Br-+H2O HBr+OH-
HBr+OH-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:填空题
某二元酸(用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液________(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”),原因是______________________。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下关系一定正确的是________(填字母)。
A.c(H+)·c(OH-)=1×10-14 mol·L-1
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:选择题
水的电离平衡曲线如图所示,下列说法不正确的是( )
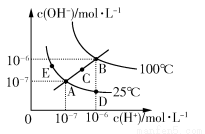
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量NH4Cl固体的方法
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:填空题
强酸制弱酸是复分解反应的一条重要规律。这里的“强酸”、“弱酸”指相对强弱,能呈现酸性的一些非酸类物质,如酚类、两性氢氧化物、酸式盐等参与的反应也可根据其酸性强弱运用上述规律来判断其产物。
(1)HA、H2B是两种弱酸,有如下关系:H2B(少量)+2A-=B2-+2HA,则A-、HB-、B2-三种离子中,最易结合质子(H+)的是________。
(2)酸性强弱除与物质的本性有关外,还与溶剂有关,如CH3COOH与HF在液氨中受NH3影响可发生完全电离。在液氨中CH3COONa+HCl―→NaCl+CH3COOH这一反应能否发生________(填“能”或“否”),理由是____________________。
(3)某同学实验发现,将H2S气体通入CuSO4溶液中,生成黑色沉淀。弄清沉淀是CuS后,写出了化学方程式:H2S+CuSO4=CuS↓+H2SO4。但随后他陷入了困惑:这不是弱酸制得强酸了吗?与强酸制弱酸的规律矛盾了。请你帮助解释__________________________________________。
(4)氧化还原反应中也有类似规律:“强氧化性物质制弱氧化性物质”、“强还原性物质制弱还原性物质”,据此判断下列反应能够发生的是________(填字母编号)。
A.FeCl2+Cl2 FeCl3
FeCl3
B.Fe+I2 FeI3
FeI3
C.Fe+CuSO4 FeSO4+Cu
FeSO4+Cu
D.FeCl3+Cu CuCl2+FeCl2
CuCl2+FeCl2
E.FeBr3+Cl2 FeCl2+Br2
FeCl2+Br2
F.FeI2+Br2 FeBr3+I2
FeBr3+I2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:填空题
甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。

①已知100°C时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为________。
②图中的p1________p2(填“<”“>”或“=”),100°C时平衡常数为________。
③在其他条件不变的情况下降低温度,逆反应速率将________(填“增大”“减小”或“不变”)。
(2)在压强为0.1 MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④该反应的ΔH________0,ΔS________0(填“<”“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
ⅰ | 150 | ? | 0.1 |
ⅱ | ________ | ________ | 5 |
ⅲ | 350 | ________ | 5 |
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:选择题
设C(s)+CO2(g) 2CO(g);ΔH1>0反应速率为v1;设N2(g)+3H2(g)
2CO(g);ΔH1>0反应速率为v1;设N2(g)+3H2(g) 2NH3(g);ΔH2<0反应速率为v2。
2NH3(g);ΔH2<0反应速率为v2。
对于上述反应,当温度降低时,v1和v2的变化情况为( )
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com