
(18分)铁及其他合物在工业生产中有着广泛的应用。请按要求回答下列问题:
I.工业上利用硫酸铁矿烧渣(主要成分为Fe2O3、Al2O3、SiO2等)为原料提取Fe2O3,工艺流程如下图1:
(1)滤液X中所含金属阳离子有 。
(2)步骤②中理论上发生反应的离子方程式依次为 。
(3)结合图2,分析步骤③调节pH的目的是 。
(4)假设流程中矿渣中的铁元素100%转化到产品中,则硫酸铁矿烧渣样品中Fe2O3的质量分数范围为(含m、n的代数式) 。
(5)请设计实验室中以硫酸铁矿烧渣为原料提取氧化铁的另一种方案:向硫酸铁矿烧渣原料中加入过量稀硫酸、充分搅拌、过滤,再向滤液中加入足量的 溶液,接下来的一系列操作是搅拌、 、洗涤、 ,最后获得纯净的产品Fe2O3。
Ⅱ.几位同学用铁盐溶液清洗试管中银镜,实验设想如下:
(6)甲:认为含Fe3+的盐无法洗去银镜。依据是Fe3+的氧化性(填“强于”或“弱于”) Ag+的氧化性,所以反应Fe3++Ag→Fe2++Ag+不可以发生。
(7)乙:查资料发现,用FeCl3溶液可以清洗银镜,于是他亲自动手实验,发现银镜迅速消失,另外还观察到溶液变为浅绿色;为验证Fe3+的还原产物,可选择的试剂为 。结合甲的分析和自己的实验现象他得出结论:反应Fe2++Ag→Fe3++Ag是(填“可逆”或“不可逆”) 反应。
(8)丙:结合甲、乙的设想,他用Fe(NO3)3溶液做对比实验,发现清洗银镜的速率慢许多,他重新观察乙的实验试管中有白色沉淀,于是结合化学平衡理论分析,得出用FeCl3溶液清洗银镜的离子方程式: 。
(1)Fe3+、Al3+ (2)2Fe3++Fe=3Fe2+、2H++Fe=Fe2++H2↑ (3)沉淀铝离子
(4)小于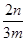 ×100% (5)氢氧化钠;过滤;灼烧 (6)弱于
×100% (5)氢氧化钠;过滤;灼烧 (6)弱于
(7)铁氰化钾溶液;可逆 (8)Fe3++Ag+Cl-=Fe2++AgCl
解析试题分析:(1)Fe2O3、Al2O3均能与稀硫酸反应生成硫酸铝、硫酸铁和水,SiO2与稀硫酸不反应,因此过滤后滤液X中主要含有铁离子和铝离子。
(2)滤液中含有过量的稀硫酸以及生成硫酸铁,二者均能与铁反应,反应的离子方程式为2Fe3++Fe=3Fe2+、2H++Fe=Fe2++H2↑。
(3)根据图2可知,随着溶液pH的升高,铝离子首先生成氢氧化铝沉淀,而溶液中的亚铁离子在留在溶液中,因此调节pH的目的是沉淀铝离子。
(4)根据流程图可知,在滤液X中加入铁粉时生成亚铁离子引入了铁元素。所以最终生成的氧化铁质量大于原矿石中氧化铁的质量。如果加入的铁粉恰好只与铁离子反应,则n值最小,此时得出的矿石中氧化铁的含量最高。设原矿石中氧化铁的物质的量是amol,则滤液X中铁离子的物质的量是2amol,根据方程式2Fe3++Fe=3Fe2+可知生成亚铁离子的物质的量是3amol,因此最终生成的氧化铁的物质的量是1.5amol,即160×1.5amol=n,解得a=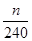 ,所以原矿石中氧化铁的含量为
,所以原矿石中氧化铁的含量为 ×100%=
×100%=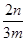 ×100%,因此样品中Fe2O3的质量分数范围为小于
×100%,因此样品中Fe2O3的质量分数范围为小于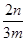 ×100%。
×100%。
(5)由于氢氧化铝是两性氢氧化物,因此要从滤液X中获得氧化铁,则可以加入过量的氢氧化钠溶液,过滤后得到氢氧化铁,洗涤后灼烧即可。
(6)根据金属活动顺序表可知,铁离子的氧化性弱于银离子的氧化性。
(7)铁离子的还原产物是亚铁离子,因此为验证Fe3+的还原产物,可选择的试剂为)铁氰化钾溶液;由于铁离子的氧化性弱于银离子的氧化性,而反应Fe2++Ag→Fe3++Ag可以发生,这说明反应应该是可逆反应。
(8)根据以上分析可知,硝酸铁溶液与银镜反应很慢,与氯化铁溶液反应快,这说明由于在反应中生成的银离子与氯离子结合生成了难溶性物质氯化银,从而促使平衡向正反应方向移动,反应的方程式为Fe3++Ag+Cl-=Fe2++AgCl。
考点:考查物质制备流程图的分析、化学实验基本操作、含量测定与计算以及外界条件对平衡状态的影响


科目:高中化学 来源: 题型:单选题
Al、Cu都是重要的金属元素。下列说法正确的是
| A.两者对应的氧化物均为碱性氧化物 |
| B.两者的单质都能与稀硫酸反应产生氢气 |
| C.常温条件下,两种金属都能溶解于浓硝酸中 |
| D.用惰性电极电解AlCl3、CuCl2的水溶液均可得到氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)信息时代产生的大量电子垃圾对环境构成严重威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含Cu、Fe及少量Au、Pt等金属的混合物,并用如下流程制备胆矾晶体(CuSO4?5H2O):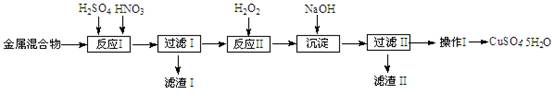
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀 | 1.5 | 6.4 | 4.2 |
| 完全沉淀 | 3.2 | 8.9 | 6.7 |
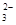 = 2Iˉ+S4O
= 2Iˉ+S4O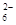
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下图所示(部分产物及反应条件已略去)。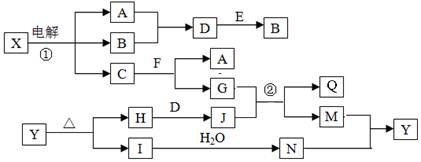
已知A、B为气态单质,F是地壳中含量最多的金属元素的单质:E、H、I为氧化物,E为黑色固体,H为红棕色粉末,I为红棕色气体;M为红褐色沉淀,Q为白色胶状物质。
请回答下列问题:
(1)组成单质F的元素在周期表中的位置是______;C中存在的化学键类型为____;E的化学式是___。
(2)A在B中燃烧的现象是_______ 。
(3) D+E→B的反应中,被氧化与被还原的物质的物质的量之比是_______。
(4)反应①的化学方程式为___________________________________ 。
(5)反应②的离子方程式为___________________________________。
(6)Y受热分解可生成H、I和氧气,.写出该反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下图是研究铜与浓硫酸的反应装置: 
(1)A试管中发生反应的化学方程式为 。
(2)反应一段时间后,可观察到B试管中的现象为 。
(3)C试管口浸有NaOH溶液的棉团作用是 。
(4)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是 。
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
| 资料1 |  附表铜与浓硫酸反应产生黑色物质的相关性质 |
| 资料2 | X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下: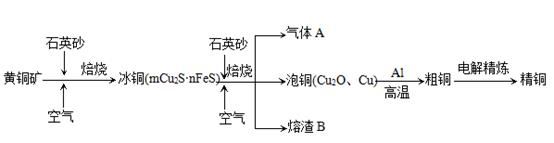
(1)气体A中的大气污染物可选用下列试剂中的_______
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化,据此回答有关问题: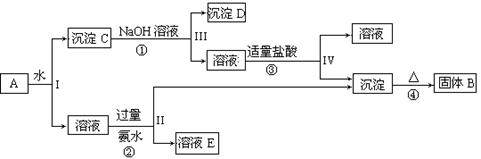
(1)I、II、III、IV中溶液和沉淀分离采取的实验操作需要用到的玻璃仪器是 、 、 。 固体B的化学式为 。
(2)按要求写出上述过程①、②、③中发生的主要反应的离子方程式
① 。
② 。
③ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: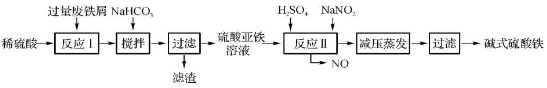
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废
铜粉制备硫酸铜晶体。生产过程如下: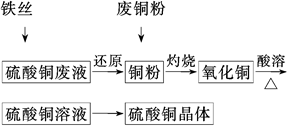
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有______________________________________________
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因可能是:
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂可能是________,该反应的化学方程式是___________________
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)____________________。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是__________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com