
已知在800 K时,反应:CO(g)+H2O(g)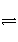
 H2(g)+CO2(g),若初始浓度c0(CO)=2 mol·L-1,c0(H2O)=3 mol·L-1,则反应达到平衡时,CO转化成CO2的转化率为60%,如果将H2O的初始浓度加大为6 mol·L-1,试求此时CO转化为CO2的转化率。
H2(g)+CO2(g),若初始浓度c0(CO)=2 mol·L-1,c0(H2O)=3 mol·L-1,则反应达到平衡时,CO转化成CO2的转化率为60%,如果将H2O的初始浓度加大为6 mol·L-1,试求此时CO转化为CO2的转化率。
此时CO转化为CO2的转化率为75%。
解析 (1)平衡转化率与平衡常数不同,它受到反应物初始浓度的影响。
(2)平衡转化率的数学表达式是涉及平衡转化率计算的基本依据。
由第一次平衡时CO的转化率可求出平衡时各物质的浓度:[CO]=0.8 mol·L-1,[H2O]=1.8 mol·L-1,[H2]=1.2 mol·L-1,[CO2]=1.2 mol·L-1,K=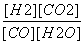 =
=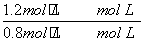 =1,假设第二次平衡时,CO的转化浓度为x。
=1,假设第二次平衡时,CO的转化浓度为x。
CO(g)+H2O(g)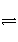
 H2(g)+CO2(g)
H2(g)+CO2(g)
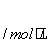 2 6 0 0
2 6 0 0
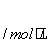 2-x 6-x x x
2-x 6-x x x
则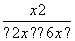 =1,解得x=1.5 mol·L-1,故CO的转化率为
=1,解得x=1.5 mol·L-1,故CO的转化率为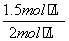 ×100%=75%。
×100%=75%。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(1)25。C时,0.1mol/L的HA溶液中c(H+)/c(OH-)=1010.请回答下列问题:
①HA是__________(填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是_________(填字母)。
A. c(H+)/c(HA) B. c(HA) /( A-)
C. c(H+)与c(OH-)的乘积 D.c(OH-)
(2)已知:CH4+H2O=CO(g)+3H2(g) 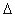 H=+206.2kJ·mol-1
H=+206.2kJ·mol-1
CH4+CO 2=2CO(g)+2H2(g) 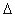 H=-247.4kJ·mol-1
H=-247.4kJ·mol-1
CH4(g)与H2O(g)反应生成CO 2(g)和H2(g)的热化学方程式为__________.
(3)下图是利用甲烷燃料电池电解50 mL 2mol/L的氯化铜溶液的装置示意图:
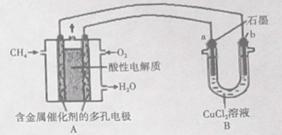
请回答:
①甲烷燃料电池的负极反应式为_______________.
②当线路中有0.6mol电子通过时,B中阳极产物的质量为___________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27 g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050 mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式:
;
(2)试通过计算确定该钠块中钠元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝溶液,并用于烟气脱硫。
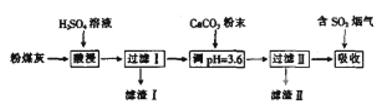
(1) (“能”或“不能”)用NaOH溶液代替H2SO4溶液。
(2)酸浸时反应的离子方程式为
(3)加CaCO3调节溶液的pH至3.6,其目的是 。Al2(SO4)x(OH)6-2x______(填“易”或“难”)于水。
(4)已知粉煤灰中Al2O3的质量分数为40.8%,制得的碱式硫酸铝【Al2(SO4)x(OH) 6-2x】中x=1.5.某实验小组取80.0g粉煤灰进行上述实验,假设在整个过程中铝的损耗率为10%,则可制得碱式硫酸铝的质量为__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在一定条件下2SO2(g)+O2(g)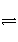
 2SO3(g) ΔH=-Q kJ·mol-1。向一密闭容器中加入2 mol SO2和1 mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2 mol SO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
2SO3(g) ΔH=-Q kJ·mol-1。向一密闭容器中加入2 mol SO2和1 mol O2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2 mol SO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( )
A.Q>Q1>Q2 B.Q1>Q2>Q C.Q1>Q>Q2 D.Q1=Q2>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家预言超级原子的发现将会重建周期表,2005年1月美国科学家在《Science》上发表论文,宣布发现了A1的超原子结构A113和A114,并在质谱仪检测到稳定的A113I一等,Al13、Al14的性质很像现行周期表中的某主族元素,己知这类超原子当具有40个价电子时最稳定(例Al原子具有3个价电子)。下列说法不正确的是
A. Al14有42个价电子,且与IIA族元素性质相似
B. Al13有39个价电子,且与卤素性质类似
C. Al13在气相中与HI反应可生成H Al13I,且化学
方程式为 AI13+HI=H AI13I
D. Al13原子中A1原子间是通过离子键结合的
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是元素周期表中五种短周期元素,原子序数依次增大。 A、B、C、D位于同一周期。已知A原子核外有3个能级,且每个能级上的容纳的电子数目相同。C与E同主族,且C的单质为空气中的主要成份。X元素的原子核外有26个运动状态完全不相同的电子。回答下列问题:
(1)C、D、E中第一电离能最大的是 (填元素符号),X的价电子排布式为
。
(2)B的气态氢化物分子呈 形。该分子的中心原子的杂化方式为 。
 (3)A的一种单质相对分子质量为720,分子构型为一个32面体,
(3)A的一种单质相对分子质量为720,分子构型为一个32面体,
|
种单质中π键的数目为 。
(4)X元素对应的单质在形成晶体时,采用如图2所示
 的堆积方式。则这种堆积模型的配位数为 ,
的堆积方式。则这种堆积模型的配位数为 ,
如果X的原子半径为a cm,阿伏加德常数的值为
NA,则计算此单质的密度表达式为 g/cm3
|
查看答案和解析>>
科目:高中化学 来源: 题型:
在冰晶石(Na3[AlF6])晶胞中,[AlF6]3-占据的位置相当于NaCl晶胞中Cl-占据
的位置,则冰晶石晶胞中含有的原子数与NaCl晶胞中含有的原子数之比为 ( )
A.2∶1 B.3∶2 C.5∶2 D.5∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com