

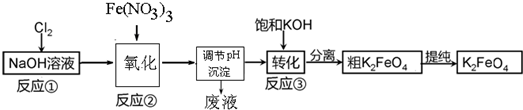
分析 由(4)戊是贮氯气装置,可知甲装置制备二氧化硫,二氧化硫与氯气在丙中反应生成SO2Cl2,丙中活性炭可能起催化剂作用,SO2Cl2遇水发生剧烈的水解反应,乙为干燥二氧化硫,E中盛放溶液加入戊中排出装置内氯气,可以是饱和食盐水,降低氯气溶解度,丁干燥氯气,SO2Cl2沸点低、易挥发,B为冷凝管,使挥发的产物SO2Cl2冷凝回流,碱石灰吸收为反应的二氧化硫、氯气,防止污染空气,并吸收空气中的水蒸气,防止进入B中导致磺酰氯水解,
(1)根据装置图可知,E为分液漏斗,根据上面的分析可知C的作用;
(2)根据逆流冷却的效果好判断进水口,因蛇形冷凝管的作用是冷凝回流而反应又没有加热,据此判断SO2与氯气间的反应的热效应,该反应是放热反应,降低温度能使平衡正向移动;
(3)甲是制备SO2的装置,铜与浓硫酸反应需要加热,硝酸能氧化SO2,据此答题;
(4)因氯水不溶于饱和食盐水,故E中的试剂是饱和食盐水,浓盐酸与二氧化锰反应生成氯化锰和Cl2,装置乙和丁都是用来干燥气体,所以都可以用浓硫酸;
(5)分离沸点不同的液体可以用蒸馏的方法,标准状况下,896mlCl2为0.04mol,故理论上可得到0.04molSO2Cl2,由此可求出产率.
解答 解:(1)根据装置图可知,E为分液漏斗,根据上面的分析可知C的作用是吸收逸出的有毒的Cl2、SO2,防止污染环境,防止空气中的水蒸气进入B使磺酰氯水解,
故答案为:分液漏斗;吸收逸出的有毒的Cl2、SO2,防止污染环境,防止空气中的水蒸气进入B使磺酰氯水解;
(2)根据逆流冷却的效果好可知,冷凝水下进上出,a口接入,因蛇形冷凝管的作用是冷凝回流而反应又没有加热,故SO2与氯气间的反应为放热反应,该反应是放热反应,降低温度能使平衡正向移动,有利于二氯化砜的生成,故答案为:分液漏斗;放;a;该反应是放热反应,降低温度能使平衡正向移动,有利于二氯化砜的生成,
故答案为:a;放热;冷凝降温有利于SO2Cl2生成;
(2)检验甲装置气密性的方法是:塞好恒压漏斗上方的塞子,将蒸馏烧瓶的导气管进入水中,酒精灯微热,导管口有气泡产生,停止加热,导管口有一段液柱产生,则装置的气密性良好,
故答案为:塞好恒压漏斗上方的塞子,将蒸馏烧瓶的导气管进入水中,酒精灯微热,导管口有气泡产生,停止加热,导管口有一段液柱产生,则装置的气密性良好;
(3)甲是制备SO2的装置,铜与浓硫酸反应需要加热,硝酸能氧化SO2,所以用c.60% H2SO4+K2SO3来制备SO2,故选c;
(4)因氯水不溶于饱和食盐水,故E中的试剂是饱和食盐水,浓盐酸与二氧化锰反应生成氯化锰和Cl2,反应的离子方程式为MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn 2++Cl2↑+2H2O,装置乙和丁都是用来干燥气体,所以都可以用浓硫酸,
故答案为:饱和食盐水;MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn 2++Cl2↑+2H2O;浓硫酸;
(5)分离沸点不同的液体可以用蒸馏的方法,所以丙中混合物分离开的实验操作是蒸馏,标准状况下,896mlCl2为0.04mol,故理论上可得到0.04molSO2Cl2,即为0.04×135g=5.4g,所以SO2Cl2的产为$\frac{3.3g}{5.4g}$×100%=61.1%,故答案为:蒸馏;61.1%.
点评 本题考查实验制备方案,涉及对反应原理、装置及操作的分析评价、对仪器的识别、物质的分离提纯等,注意对物质性质信息的应用,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
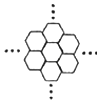 据报道,科学家已经研制出世界上最薄的材料--碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成.下列有关碳膜片的说法中正确的是( )
据报道,科学家已经研制出世界上最薄的材料--碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成.下列有关碳膜片的说法中正确的是( )| A. | 碳膜片中每个六边形平均由两个碳原子构成 | |
| B. | 碳膜片与C60是同一种物质 | |
| C. | 碳膜片属于人工合成的有机化合物 | |
| D. | 碳膜片在氧气中完全燃烧的产物和碳在氧气中完全燃烧的产物不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在铁门上焊接铜块既美观,又能防腐蚀 | |
| B. | 古代青铜文物在干燥环境中的腐蚀比潮湿环境中快 | |
| C. | 纯银器表面在空气中因化学腐蚀渐渐变暗 | |
| D. | 可将地下输油管与外加直流电源的正极相连以保护它不受腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +6 | B. | +4 | C. | +3 | D. | +2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 离子 | Cu2+ | Fe2+ | Fe3+ |
| 开始沉淀时的pH | 4.7 | 5.8 | 1.9 |
| 完全沉淀时的pH | 6.7 | 9.0 | 3.2 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 伴随着能量变化的物质变化都是化学变化 | |
| C. | 如图可表示Ba(OH)2•8H2O与NH4Cl晶体反应的能量变化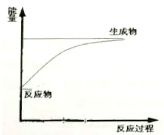 | |
| D. | 1L1mol/L的硫酸与足量的NaOH溶液所放出的热为中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na[Al(OH)4]溶液中通入过量CO22[Al(OH)4]-+CO2=2Al(OH)3↓+CO32-+H2O | |
| B. | FeO和稀HNO3反应FeO+2H+=Fe2++H2O | |
| C. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制备Fe(OH)2Fe2++NH4++3OH-=Fe(OH)2↓+NH3?H2O | |
| D. | NaHSO4与Ba(OH)2混合至溶液呈中性Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com